Chemische Reaktionen zur gezielten Stoffproduktion
Die gezielte Herstellung eines Stoffes in der Chemie erfolgt durch spezifische chemische Reaktionen, welche als Synthesereaktion bekannt sind. In diesem Prozess wird ein Zielmolekül aus bestimmten Vorstufen systematisch und oft unter Einsatz von Katalysatoren erzeugt. Der Schlüssel zu einer effektiven Herstellung eines Produkts liegt im Verständnis des Reaktionsmechanismus und der präzisen Steuerung der chemischen Produktion.
Eine zentrale Rolle spielt die Kenntnis über optimale Reaktionsbedingungen und Methoden zur selektiven Synthese. Durch diese zielgerichteten chemischen Verfahren können gewünschte Verbindungen effizient und mit hoher Reinheit produziert werden. Sowohl in der industriellen Chemiesynthese als auch bei Laborverfahren zur Stoffherstellung kommt es auf die geschickte Anwendung von Synthesestrategien an, um die präparative Chemie effektiv zu gestalten.
Um dabei erfolgreich zu sein, müssen Synthesepläne sorgfältig ausgearbeitet und die einzelnen Schritte gemäß den Anforderungen des gewünschten Endprodukts optimiert werden. Dies ermöglicht eine präzise chemische Produktion, die genau die gewünschten Eigenschaften aufweist und somit den Bedarf nach spezifischen Substanzen deckt.
Das Wichtigste in Kürze
- Synthesereaktionen: Herstellung spezifischer Stoffe aus Vorstufen durch gezielte chemische Prozesse.
- Katalyse: Erhöhung der Reaktionsgeschwindigkeit durch Katalysatoren, ohne verbraucht zu werden.
- Elektrolyse: Stofftrennung und Gewinnung reiner Elemente durch elektrischen Strom.
- Fermentation: Biochemische Umwandlung durch Mikroorganismen zur Produktion von Biofuels und Lebensmitteln.
- Polymerisation: Verknüpfung von Monomeren zu Polymeren für Kunststoffe und andere Materialien.
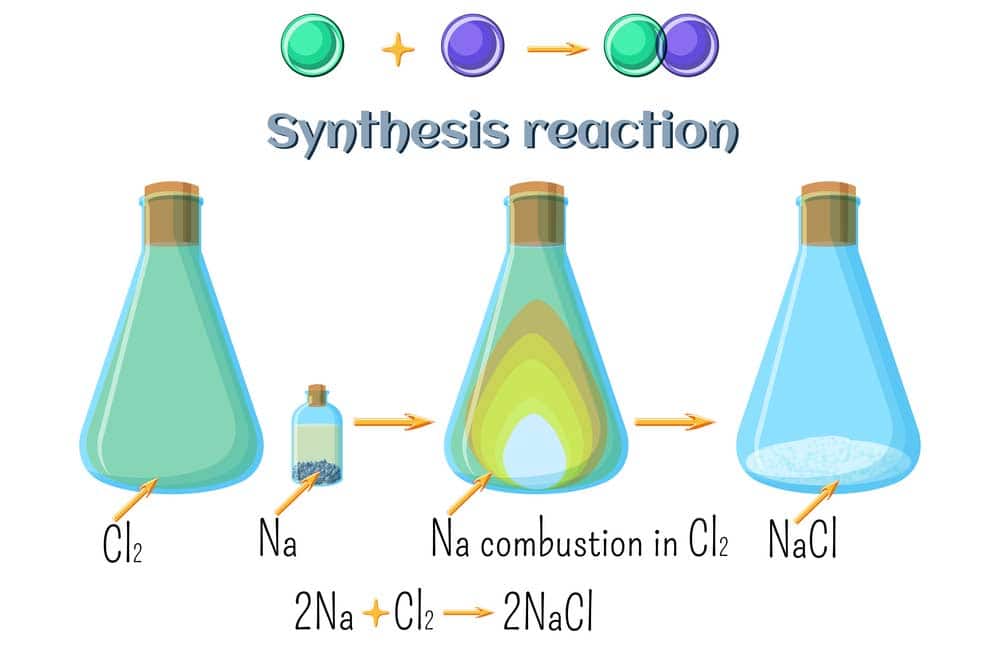
Bei einer Synthesereaktion wird ein Stoff gezielt hergestellt, indem zwei oder mehr Ausgangsstoffe miteinander reagieren, um ein spezifisches Produkt zu bilden. Synthesereaktionen werden häufig in der organischen Chemie eingesetzt, um komplexe Moleküle oder Verbindungen herzustellen, die in der Industrie, Medizin oder anderen Bereichen benötigt werden.
Chemische Reaktion bei der Stoffe entstehen
Die gezielte Herstellung von Stoffen in der Chemie erfolgt häufig durch Synthesereaktionen. Ein herausragendes Beispiel dafür ist das Haber-Bosch-Verfahren zur Ammoniaksynthese.
Ammoniaksynthese (Haber-Bosch-Verfahren)
- Reaktionsgleichung: N2+3H2→2NH3N2+3H2→2NH3
- Prozess: Stickstoff (N₂) und Wasserstoff (H₂) reagieren unter hohem Druck und bei hoher Temperatur in Anwesenheit eines Katalysators zu Ammoniak (NH₃).
- Bedeutung: Ammoniak ist ein wichtiger Bestandteil für die Herstellung von Düngemitteln und hat daher immense industrielle Bedeutung.
Weitere Beispiele für gezielte Stoffherstellung
- Polymerisation:
- Kleine Moleküle (Monomere) werden zu langen Ketten oder Netzen (Polymere) verbunden.
- Anwendung: Herstellung von Kunststoffen wie Polyethylen und PVC.
- Elektrolyse:
- Elektrischer Strom wird verwendet, um chemische Verbindungen zu zerlegen.
- Beispiel: Gewinnung von Aluminium aus Bauxit.
- Fermentation:
- Mikroorganismen werden genutzt, um bestimmte Produkte herzustellen.
- Anwendungen: Produktion von Ethanol, Antibiotika und anderen nützlichen Stoffen.
| Reaktion | Beschreibung |
|---|---|
| Synthesereaktion | Gezielte Herstellung eines Produkts durch kontrollierte chemische Prozesse. |
| Katalyse | Erhöhen der Reaktionsgeschwindigkeit durch Katalysatoren ohne deren Verbrauch. |
| Elektrolyse | Stofftrennung durch elektrischen Strom. |
| Fermentation | Biochemische Umwandlung durch Mikroorganismen. |
| Polymerisation | Verknüpfung von Monomeren zu Polymeren. |
| Veresterung | Umwandlung von Alkohol und Säure zu Ester. |
| Redoxreaktion | Elektronenaustausch zur Stoffherstellung. |
| Hydrolyse | Spaltung chemischer Bindungen durch Wasser. |
Merkmale gezielter Stoffherstellung
Bei der gezielten Herstellung eines Stoffes sind folgende Aspekte wichtig:
- Kontrolle der Reaktionsbedingungen: Temperatur, Druck, Konzentration der Reaktanten und die Anwesenheit von Katalysatoren müssen sorgfältig gesteuert werden.
- Optimierung der Ausbeute: Die Reaktionsbedingungen sollten angepasst werden, um die Menge des gewünschten Produkts zu maximieren.
- Reinheit des Produkts: Methoden zur Minimierung von Nebenprodukten werden angewandt, um das gewünschte Produkt in hoher Reinheit zu erhalten.
- Skalierbarkeit: Die Reaktion muss vom Labor- in den industriellen Maßstab übertragbar sein, um wirtschaftlich relevant zu sein.
Durch die präzise Steuerung dieser Faktoren können Chemiker und Ingenieure chemische Reaktionen nutzen, um spezifische Stoffe in großen Mengen und hoher Qualität herzustellen, was die Grundlage vieler industrieller Prozesse bildet.
Katalyse: Reaktionsgeschwindigkeit durch Katalysatoren erhöhen
Katalyse spielt eine wesentliche Rolle in der Chemie, da sie die Reaktionsgeschwindigkeit chemischer Prozesse erhöht. Durch den Einsatz von Katalysatoren können Reaktionen beschleunigt werden, ohne dass der Katalysator selbst dabei verbraucht wird.
Ein Katalysator wirkt, indem er den Aktivierungsenergie-Berg senkt, den Moleküle überwinden müssen, um zu reagieren. Dadurch entstehen Produkte schneller und oft auch mit höherer Ausbeute. Dies ist besonders nützlich bei der Herstellung spezifischer Stoffe, wo hohe Präzision und Effizienz gefragt sind.
In der industriellen Chemiesynthese und präparativen Chemie ermöglicht die Katalyse die Produktion großer Mengen an Chemikalien unter optimierten Bedingungen. Dies ist entscheidend für die gezielte Synthesereaktion und gezielte chemische Transformation.
Durch sorgfältige Wahl des geeigneten Katalysators lässt sich die selektive Synthese gewünschter Verbindungen realisieren. Beispielsweise können Katalysatoren so gestaltet werden, dass sie nur bestimmte Reaktionen fördern, was zur präzisen chemischen Produktion führt.
Im Laborverfahren zur Stoffherstellung ist die Katalyse ein unverzichtbares Werkzeug. Hierbei wird oft experimentiert, um die besten Katalysatoren und Bedingungen für einen Syntheseplan zu finden, der ideal für die Herstellung eines Produkts oder das Design neuer chemischer Verfahren geeignet ist.
Die Katalyse ist nicht nur eine chemische Technik, sondern der Schlüssel zur modernen Weltchemie. – Fritz Haber
Synthese: Zielmolekül gezielt aus Vorstufen herstellen
Die Synthese ist ein grundlegendes Verfahren in der Chemie, bei dem ein Zielmolekül gezielt aus Vorstufen hergestellt wird. Dies erfolgt durch die gezielte Kombination von Ausgangsstoffen unter bestimmten Bedingungen, um eine gewünschte Verbindung zu produzieren. Dabei werden verschiedene chemische Reaktionen genutzt, um Atome und Moleküle in spezifischen Arrangements miteinander zu verknüpfen.
Eine Synthesereaktion kann in organischer oder anorganischer Chemie stattfinden und spielt eine zentrale Rolle bei der Herstellung eines Produkts. Die präparative Chemie beschäftigt sich intensiv mit dieser Aufgabe, indem sie optimierte Reaktionsbedingungen entwickelt, um die Ausbeute und Reinheit des gewünschten Produkts zu maximieren.
In der präzisen chemischen Produktion sind detaillierte Kenntnisse über den Reaktionsmechanismus notwendig. Diese Kenntnisse ermöglichen es, Produkte effizient herzustellen, indem unerwünschte Nebenprodukte minimiert werden. Auch das Verständnis für katalytische Prozesse ist hierbei hilfreich, da Katalysatoren die Reaktionsgeschwindigkeit erhöhen und ebenfalls zur Produktentwicklung in der Chemie beitragen.
Moderne chemische Verfahren nutzen oft eine Kombination verschiedener Methoden zur Herstellung spezifischer Stoffe. Dazu gehört etwa die Verwendung von Schutzgruppen, mehrstufige Syntheserouten und computergestützte Designmethoden. Durch diese zielgerichteten Methoden können hochkomplexe Moleküle, wie Medikamente oder Spezialchemikalien, effektiv produziert werden. Diese selektive Synthese ermöglicht es, neue Materialien und Substanzen mit maßgeschneiderten Eigenschaften zu entwickeln.
Beispiele für die Synthese:
- Die Synthese von Aspirin (Acetylsalicylsäure) aus Salicylsäure und Essigsäure
- Die Herstellung von Ethanol durch die Fermentation von Zucker
- Die Synthese von Nylon aus Dicarbonsäuren und Diaminen
- Die Produktion von Ethylacetat aus Essigsäure und Ethanol
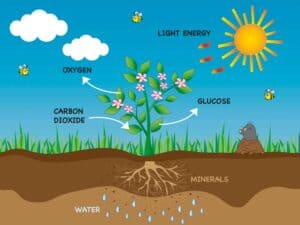
- Die Synthese von Glucose aus Kohlendioxid und Wasser in Pflanzen durch Photosynthese
- Die Herstellung von Polyethylen durch Polymerisation von Ethen
- Die Synthese von Ammoniak aus Stickstoff und Wasserstoff
- Die Produktion von Aceton durch die Dehydratisierung von 2-Propanol
Elektrolyse: Stofftrennung durch elektrischen Strom
Die Elektrolyse ist ein chemisches Verfahren, bei dem ein Stoff mithilfe von elektrischem Strom getrennt wird. Dieses Verfahren findet breite Verwendung in der chemischen Produktion und präparativen Chemie. Ein bekanntes Beispiel für die Elektrolyse ist die Herstellung von Wasserstoff und Sauerstoff aus Wasser.
Elektrolyse ermöglicht es, Substanzen in ihre Grundbausteine zu zerlegen, und wird daher oft zur Gewinnung reiner Elemente genutzt. In industriellen Verfahren wird sie eingesetzt, um Metalle wie Aluminium oder Chlorchemikalien herzustellen. Die gezielte Trennung der Moleküle erfolgt durch das Anlegen einer elektrischen Spannung an eine Elektrolytlösung, was zur Wanderung der Ionen führt.
Ein Vorteil dieses Verfahrens liegt in der Reaktionssteuerung sowie der selektiven Synthese bestimmter Produkte. Dabei sind optimierte Reaktionsbedingungen entscheidend, um die gewünschte Ausbeute zu erreichen.
Im Laborverfahren zur Stoffherstellung spielt die Elektrolyse ebenfalls eine wichtige Rolle, vor allem wenn es um die präzise chemische Produktion kleinerer Mengen handelt. Hierbei kann der Reaktionsmechanismus detailliert untersucht und angepasst werden, um spezifische Stoffe durch gezielte Synthesereaktionen zu erzeugen.
Diese unterstützt als zielgerichtete chemische Methode die Herstellung vieler Verbindungen, und trägt damit erheblich zur Produktentwicklung in der Chemie bei.
Fermentation: Biochemische Umwandlung durch Mikroorganismen
Fermentation bezeichnet die biochemische Umwandlung von Substraten durch Mikroorganismen wie Bakterien, Pilze oder Hefen. Diese Mikroorganismen nutzen die vorhandenen Nährstoffe und wandeln sie in verschiedene Produkte um, oft unter anaeroben Bedingungen. Die Fermentation ist ein entscheidendes Verfahren sowohl in der Lebensmittelindustrie als auch bei der Herstellung von Biofuels und Arzneimitteln.
Ein herausragendes Beispiel für die Anwendung der Fermentation ist die Produktion von Ethanol aus Zuckerrohr oder Mais. Hierbei wandeln Hefen die Zucker zu Ethanol und Kohlendioxid um. Dieses Prinzip lässt sich auch auf die Herstellung von Milchsäurebakterien anwenden, welche bei der Produktion von Joghurt, Sauerkraut und anderen fermentierten Lebensmitteln eine zentrale Rolle spielen.
Wichtig ist die Steuerung der Fermentationsbedingungen, wie Temperatur, pH-Wert und Sauerstoffgehalt. So lassen sich gezielt bestimmte Endprodukte erzeugen und das Wachstum unerwünschter Nebenprodukte minimieren. Durch präzise Überwachung und Anpassung können die Resultate optimiert werden, was diese Methode besonders wertvoll macht.
In modernen biotechnologischen Anwendungen wird die Fermentation oft mit genetisch modifizierten Mikroorganismen durchgeführt, um effizientere Produktionsprozesse zu erreichen. Dies erlaubt es, eine Vielzahl von chemischen Verbindungen herzustellen, die sonst nur schwer oder gar nicht synthetisiert werden könnten.
Polymerisation: Monomere zu Polymeren verknüpfen
Das Verfahren der Polymerisation ist ein bedeutendes chemisches Verfahren, bei dem Monomere, also einzelne Moleküle, zu größeren Polymeren verknüpft werden. Diese Reaktion spielt eine wichtige Rolle in der Herstellung eines Produkts wie Kunststoffe, Fasern und viele andere Materialarten.
Es gibt verschiedene Methoden zur Durchführung einer gezielten Synthesereaktion der Polymerisation, darunter die Kettenpolymerisation und die Stufenwachstumspolymerisation. Bei der Kettenpolymerisation wächst das Polymer durch die Addition von Monomeren an eine aktive Stelle des wachsenden Polymers. Im Gegensatz dazu erfolgt bei der Stufenwachstumspolymerisation die Verknüpfung der Monomere schrittweise und gleichmäßig, bis das gesamte Polymer gebildet ist.
Für die erfolgreiche Umsetzung dieses chemischen Prozesses ist es wichtig, optimierte Reaktionsbedingungen zu gewährleisten. Dabei können Katalysatoren oder bestimmte Reaktionsstarter verwendet werden, um den Verlauf der Polymerisation gezielt zu steuern und die gewünschte Molekularstruktur zu erreichen. Dies ermöglicht eine präzise chemische Produktion spezifischer Polymere.
Durch den gezielten Einsatz verschiedener Polymerisationstechniken können Chemiker im Laborverfahren zur Stoffherstellung maßgeschneiderte Materialien entwickeln. Dies trägt erheblich zur industriellen Chemiesynthese bei, wo große Mengen an Polymeren für unterschiedliche Anwendungen benötigt werden. Auch im Bereich der Produktentwicklung in der Chemie spielt die Polymerisation oft eine zentrale Rolle, da sie vielseitige Möglichkeiten bietet, neue Materialien mit gewünschten Eigenschaften herzustellen.
Die weltweit bekannte Anwendung sorgfältig geplanter Synthesestrategien bei der Polymerisation unterstreicht ihre Bedeutung in der gezielten chemischen Produktion, von der Grundlagenforschung bis hin zur industriellen Anwendung.
| Verfahren | Beschreibung | Beispiele |
|---|---|---|
| Synthesereaktion | Gezielte Herstellung eines Produkts durch kontrollierte chemische Prozesse. | Medikamentensynthese, Herstellung von Farbstoffen |
| Katalyse | Erhöhen der Reaktionsgeschwindigkeit durch Katalysatoren ohne deren Verbrauch. | Ammoniaksynthese, Abgaskatalysatoren |
| Elektrolyse | Stofftrennung durch elektrischen Strom. | Wasserstoffproduktion, Chlor-Alkali-Elektrolyse |
Veresterung: Alkohol und Säure zu Ester umwandeln
Die Veresterung ist eine chemische Reaktion, bei der ein Alkohol und eine Säure miteinander reagieren, um einen Ester zu bilden. Solche Reaktionen sind von großer Bedeutung sowohl in der organischen Chemie als auch in verschiedenen Industriezweigen.
Während des Prozesses kommt es zur Abscheidung von Wasser, weshalb diese Reaktion auch als Kondensationsreaktion bekannt ist. Ein klassisches Beispiel für eine Veresterung ist die Bildung von Essigester (Ethylacetat) aus Ethanol und Essigsäure.
Diese Reaktionen finden nicht nur im Labor statt, sondern spielen auch eine Rolle bei der Herstellung spezifischer Stoffe wie Kunststoffe, Weichmacher oder Aromen. Durch den Einsatz gezielter Synthesestrategien lässt sich die Ausbeute maximieren und die Selektivität der Reaktion erhöhen. In industriellen Anwendungen werden häufig Katalysatoren verwendet, um die Reaktion bei niedrigeren Temperaturen und Drücken effizienter zu gestalten.
Die präparative Chemie nutzt die Veresterung als zielgerichtete chemische Methode, um bestimmte Estertypen herzustellen, die dann weiterverarbeitet oder direkt in Produkten verwendet werden. Optimierte Reaktionsbedingungen tragen hierzu erheblich bei, da sie die gewünschte Verbindung mit hoher Reinheit und präziser Kontrolle über Nebenprodukte produzieren lassen.
Das Wissen über die Reaktionsmechanismen und die Steuerung der Bedingungen ermöglicht eine präzise chemische Produktion auf höchstem Niveau.
Redoxreaktion: Elektronenaustausch für Stoffherstellung
Redoxreaktionen spielen eine zentrale Rolle bei der Herstellung gezielter chemischer Verbindungen durch Elektronenaustausch. Diese Prozesse sind essenziell in der präparativen Chemie, da sie häufig zur Erzeugung von Produkten eingesetzt werden, die sonst schwer herzustellen wären.
In einer typischen Redoxreaktion findet ein Elektronentransfer zwischen einem Oxidationsmittel und einem Reduktionsmittel statt. Dieser Mechanismus ermöglicht die Synthese unterschiedlichster Substanzen, von einfachen Metallen bis hin zu komplexen organischen Molekülen. Durch diese Methode können chemische Bindungen gezielt gebildet oder gespalten werden, was in der Industrie und im Laborverfahren zur Stoffherstellung unverzichtbar ist.
Die kontrollierte Anwendung von Redoxreaktionen erlaubt eine präzise Steuerung der chemischen Prozesse. Mit optimierten Reaktionsbedingungen lässt sich die selektive Synthese bestimmter Produkte erreichen. Dies ist insbesondere für die industrielle Chemiesynthese von Bedeutung, um hochreine Stoffe zu erhalten.
Redoxreaktionen bieten eine zielgerichtete chemische Methode zur Herstellung spezifischer Stoffe. Sie bilden die Grundlage zahlreicher chemischer Produktionsprozesse, sowohl in der Forschung als auch in der industriellen Anwendung.
Hydrolyse: Wasser zur Spaltung chemischer Bindungen
Hydrolyse ist eine wesentliche chemische Reaktion, bei der Wasser zur Spaltung von Bindungen in Molekülen verwendet wird. Dieses Verfahren kommt häufig sowohl in biologischen als auch in industriellen Prozessen vor.
Ein Beispiel für die Hydrolyse ist die Spaltung von Peptidbindungen in Proteinen durch Enzyme wie Pepsin oder Trypsin. Diese Enzyme nutzen Wasser, um die Verbindung zwischen Aminosäuren zu trennen. Wasser fungiert hierbei als nukleophiler Angreifer, der das Molekül aufbricht und neue Verbindungen schafft.
In der industriellen Chemie wird die Hydrolyse genutzt, um Ester in Säuren und Alkohole umzuwandeln. Diese Anwendung findet sich zum Beispiel in der Produktion von Seifen, wo Fette und Öle hydrolysiert werden, um Fettsäuren und Glycerin zu erzeugen.
Die Reaktionsbedingungen wie Temperatur, pH-Wert und Katalysatoren sind entscheidend für den Erfolg der Hydrolyse. Durch optimierte Bedingungen kann die Reaktionsgeschwindigkeit gesteigert und die Ausbeute des gewünschten Produkts erhöht werden.
Gesamt betrachtet, ist die Hydrolyse ein vielfältiges Werkzeug in der präparativen Chemie, da sie es ermöglicht, komplexe Moleküle zielgerichtet in einfachere Bestandteile zu zerlegen. Dies macht sie unverzichtbar in vielen Laborverfahren zur Stoffherstellung sowie in der industriellen Produktion spezifischer Substanzen.
Mit ihrer präzisen Reaktionssteuerung bietet die Hydrolyse eine effektive Methode zur Herstellung gewünschter Verbindungen unter Einsatz minimaler Ressourcen.