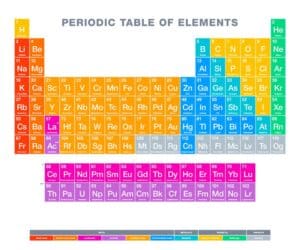
Das Periodensystem der Elemente ist ein unverzichtbares Werkzeug in der Chemie und hilft, die Eigenschaften von Elementen und ihre Reaktionen zu verstehen. Seit seiner Einführung durch Dmitri Mendelejew im 19. Jahrhundert hat es zahlreiche Veränderungen erlebt. Jedes Element besitzt eine einzigartige Ordnungszahl, die seine Position im Periodensystem definiert. Mit jeder Entdeckung eines neuen Elements wird das Wissen über die chemische Welt erweitert. Aktuell umfasst das Periodensystem insgesamt 118 bekannte Elemente.
Das Wichtigste in Kürze
- Das Periodensystem umfasst derzeit 118 anerkannte chemische Elemente.
- Neue Elemente werden oft durch Kernfusion in Teilchenbeschleunigern entdeckt.
- Der Prozess der Elementanerkennung erfordert strenge wissenschaftliche Bestätigungen.
- Mendelejews Periodensystem legte die Grundlage für moderne chemische Struktur.
- Entdeckungen neuer Elemente bieten Fortschritte in Wissenschaft und Technologie.
Aktuelle Anzahl der Elemente
Derzeit umfasst das Periodensystem der Elemente beeindruckende 118 anerkannte chemische Elemente. Jedes dieser Elemente ist einzigartig und nimmt einen speziellen Platz im bekannten Universum ein. Diese 118 Elemente sind in einem speziellen Schema, dem sogenannten Periodensystem, geordnet.
Wissenschaftler weltweit arbeiten kontinuierlich daran, neue Elemente zu entdecken oder zu synthetisieren. Besonders die schwereren Elemente jenseits des Urans, bekannt als Transurane, stehen hierbei im Fokus der Forschung. Diese neu entdeckten oder künstlich hergestellten Elemente haben oftmals sehr kurze Lebensdauern und existieren nur unter bestimmten Laborbedingungen.
Viele dieser jüngsten Entdeckungen wurden erst in den letzten Jahren von der International Union of Pure and Applied Chemistry (IUPAC) als offizielle Elemente anerkannt. Es ist bemerkenswert, wie viel Wissenszuwachs diese Forschungsaktivitäten mit sich gebracht haben. Die fortlaufende Erweiterung des Periodensystems zeigt nicht nur die Fortschritte in der Wissenschaft, sondern bietet auch neue Möglichkeiten für Anwendungen in verschiedenen industriellen und technologischen Bereichen.
So bleibt es spannend, welche weiteren Elemente zukünftig zum Periodensystem hinzukommen werden.
Der Wert eines wissenschaftlichen Werkzeugs bemisst sich daran, wie viele neue Fragen es aufwirft. – Stephen Hawking
| Element | Ordnungszahl |
|---|---|
| Wasserstoff | 1 |
| Helium | 2 |
| Rubidium | 37 |
| Silber | 47 |
| Blei | 82 |
Erkennung neuer Elemente
Der Prozess der Entdeckung neuer Elemente im Periodensystem ist komplex und erfordert spezialisierte Kenntnisse sowie ausgeklügelte Technologie. Elemente werden oft durch Kernfusion oder Radioaktivitätsanalysen entdeckt.
Der erste Schritt zur Entdeckung eines neuen Elements besteht darin, Atome schwerer Elemente zu fusionieren. Dies geschieht meist in Teilchenbeschleunigern, wo Kerne mit hoher Energie aufeinanderprallen. Die chemischen Eigenschaften und die Stabilität des resultierenden Materials werden anschließend untersucht.
Ein Beispiel dafür ist das Element 118, bekannt als Oganesson. Forscher haben zunächst Kalzium-Isotope auf Californium geschossen, um dieses superschwere Element zu erzeugen. Nach der Synthese wurde die Halbwertszeit des entstandenen Isotops gemessen, da viele neu entdeckte Elemente nur wenige Millisekunden existieren.
Sobald ein potentiell neues Element nachgewiesen ist, bedarf es einer eingehenden Analyse und Bestätigung durch weitere Experimente. Diese Ergebnisse müssen dann von unabhängigen Wissenschaftlern reproduziert werden, bevor das neue Element offiziell anerkannt wird.
Die Klassifizierung und Benennung dieser Elemente unterliegt strengen Richtlinien, die von der International Union of Pure and Applied Chemistry (IUPAC) festgelegt sind. Dieser rigorose Prozess stellt sicher, dass alle entdeckten Elemente authentisch und wissenschaftlich fundiert sind.
| Element | Ordnungszahl | Gruppe |
|---|---|---|
| Kohlenstoff | 6 | 14 |
| Stickstoff | 7 | 15 |
| Sauerstoff | 8 | 16 |
| Gold | 79 | 11 |
| Uran | 92 | Actinoide |
Klassifizierung anhand der Ordnungszahl
Die Klassifizierung der Elemente im Periodensystem erfolgt vorwiegend anhand ihrer Ordnungszahl, die die Anzahl der Protonen im Kern eines Atoms angibt. Jedes Element ist durch eine einzigartige Ordnungszahl definiert, was seine Position im Periodensystem bestimmt.
Mit zunehmender Ordnungszahl rücken die Elemente entsprechend in den Perioden und Gruppen weiter, wodurch sich ihre Eigenschaften systematisch ändern. Diese Änderung erstreckt sich von metallischen zu nichtmetallischen Charakteristiken und betrifft unter anderem Reaktivität, Elektronegativität und Ionisationsenergie.
Eine repräsentative Struktur des Periodensystems erleichtert es, Muster und Trends bei den chemischen und physikalischen Eigenschaften der Elemente zu erkennen. Zum Beispiel finden sich Alkalimetalle und Halogene jeweils in einer Gruppe, was bedeutet, dass sie ähnliche chemische Verhaltensmuster aufweisen.
Ferner helfen diese Einteilungen Wissenschaftlerinnen und Chemikerinnen, Vorhersagen über das Verhalten von Elementen bei chemischen Reaktionen oder unter bestimmten Bedingungen zu treffen. Durch das Verständnis der Klassifizierung können theoretische Modelle erstellt und empirische Untersuchungen zielgerichteter durchgeführt werden.
Besonders wichtig ist die Kornung auch für die Synthese neuer Verbindungen und Materialien: Ausgehend von bekannten Eigenschaften lassen sich potenziell nützliche neue Substanzen entwickeln. Dies zeigt die zentrale Rolle der Ordnungszahl bei der Organisation und Anwendung des gesamten chemischen Wissens.
Historische Entwicklung des Periodensystems
Von der ersten Aufzeichnung chemischer Elemente durch die Menschen bis zum modernen Periodensystem war es ein spannender Weg voller Entdeckungen und Erkenntnisse. Im 19. Jahrhundert erkannte der russische Chemiker Dimitri Mendelejew als einer der Ersten, dass sich die Eigenschaften der Elemente in regelmäßigen Abständen wiederholen.
Er stellte die Elemente so auf, dass ähnliche Eigenschaften untereinander angeordnet waren. Diese Tabelle hatte jedoch zunächst Lücken für damals noch nicht entdeckte Elemente. Einige seiner Vorhersagen bezüglich neuer Elemente bewahrheiteten sich später, was seine Arbeit weiter bestätigte.
Um das Jahr 1869 herum explodierte das Wissen über neue chemische Substanzen förmlich, und eine systematische Anordnung wurde immer dringlicher. Beim Entwickeln seines Systems basierte Mendelejew einige seiner Vorhersagen auf den Gewichten der bekannten Atome, was ihm erlaubte, sowohl die Eigenschaften als auch die Existenz künftiger Elemente recht genau zu prognostizieren.
Später im 20. Jahrhundert führte die Entdeckung der Atomstruktur zu weiteren Verfeinerungen des Periodensystems. Die Einführung der Ordnungszahl, also der Anzahl der Protonen im Kern eines Atoms, durch den britischen Physiker Henry Moseley brachte entscheidende Klarheit und Ordnung in die bereits bestehende Struktur.
Diese Fortschritte machten das Periodensystem zu einem unverzichtbaren Werkzeug moderner Wissenschaftler und Chemiker weltweit.
Bedeutung der Neuentdeckungen
Die Entdeckung neuer Elemente im Periodensystem hat weitreichende Konsequenzen für zahlreiche Bereiche der Wissenschaft und Technik. Ein neues Element kann zu Fortschritten in der Materialwissenschaft führen, indem es beispielsweise neue Legierungen oder Supraleiter ermöglicht.
Darüber hinaus können neu entdeckte Elemente auch in der Medizin genutzt werden. Isotope solcher Elemente spielen eine wichtige Rolle in der Radiotherapie zur Behandlung von Krebs. Durch die gezielte Anwendung radioaktiver Strahlung können Tumorzellen effektiver bekämpft werden.
Ein weiterer bedeutender Aspekt ist die Verbesserung bestehender Technologien. Neue Elemente könnten Bauteile besonders haltbar machen oder ihre Leistungsfähigkeit steigern. Beispielsweise wird intensiv daran geforscht, den Wirkungsgrad von Batterien und Akkus durch innovative Materialien zu erhöhen.
Schlussendlich trägt jede Entdeckung zur Erweiterung unseres Verständnisses über die Naturgesetze bei. Jedes Element des Periodensystems gibt Aufschluss über die atomare Struktur und die Wechselwirkungen zwischen Atomen. Diese Kenntnisse sind fundamental für das Verständnis chemischer und physikalischer Prozesse.
Zusammengefasst bieten Neuentdeckungen nicht nur unmittelbare technische Anwendungen, sondern bereichern auch unser Wissen um die Grundlagen der Materie.
Zukünftige Entdeckungen im Periodensystem
Die weitere Entwicklung des Periodensystems hängt stark von der Entdeckung neuer chemischer Elemente ab. Diese neuen Elemente können wertvolle Erkenntnisse über die Grenzen der Chemie und Physik liefern.
Derzeit stehen Forscher vor der Aufgabe, Elemente mit immer höherer Ordnungszahl zu erzeugen und zu studieren. Diese Elemente sind oft instabil und zerfallen in Bruchteilen von Sekunden, was die Erforschung erschwert. Dennoch zeigt sich hier die Faszination der Wissenschaft, da jedes neue Element unser Verständnis der Materie erweitert.
Experimente an Teilchenbeschleunigern spielen eine entscheidende Rolle bei diesen Aktivitäten. Durch Kollisionen schwerer Atomkerne können unter extremen Bedingungen neue Elemente entstehen. Der Prozess ist komplex und erfordert präzise Technik sowie umfangreiche Analysen.
Ein weiteres spannendes Forschungsgebiet betrifft die Eigenschaften dieser super-schweren Elemente. Ihre möglichen Anwendungen könnten weitreichend sein und reichen von medizinischen bis hin zu technologischen Neuerungen. Zwar wurden bislang noch keine stabilen, praktischen Verwendungszwecke für viele dieser neueren Elemente gefunden, der fortwährende Fortschritt könnte jedoch unvorhersehbare Türen öffnen.
Zusammengefasst bleibt das Periodensystem ein dynamisches Werkzeug der Wissenschaft. Die Aussicht auf zukünftige Entdeckungen hält das Feld lebendig und aufregend.