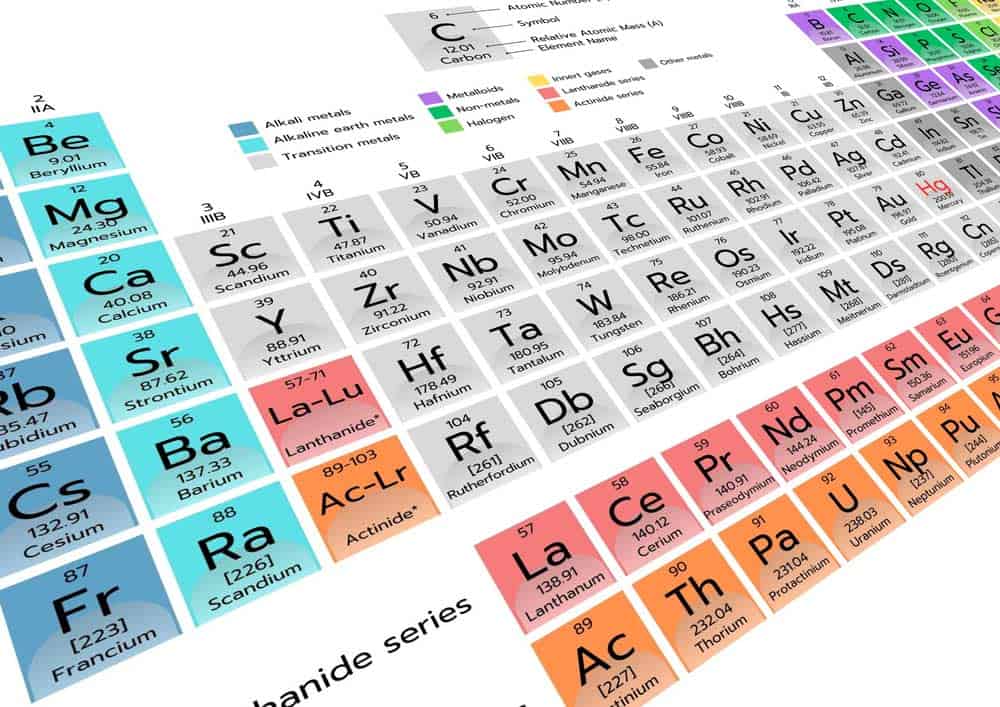
Das Periodensystem der Elemente ist nicht nur ein wesentliches Instrument in der Chemie, sondern auch eine bedeutende Ressource für zahlreiche andere Wissenschaftsdisziplinen. Mit einem einzigen Blick ermöglicht es schnell und einfach wichtige Informationen über chemische Elemente abzulesen. Von Elementname bis zur Elektronenkonfiguration, das Periodensystem bietet eine Fülle an Daten, die auf einen Blick verfügbar sind. Der Ursprung des Elements, sein Verhalten unter bestimmten Bedingungen und seine chemischen Eigenschaften können hier leicht erfasst werden.
Das Wichtigste in Kürze
- Das Periodensystem zeigt Namen, Symbole und Ordnungszahlen der Elemente.
- Es bietet Informationen zu Atommassen und Elektronenkonfigurationen.
- Gruppenzugehörigkeiten und gemeinsame chemische Eigenschaften werden hervorgehoben.
- Aggregatzustände der Elemente bei Raumtemperatur sind ablesbar.
- FAQs bieten Einblicke in besondere Eigenschaften und historische Hintergründe.
Elementname und Symbol
Im Periodensystem können der Elementname und das Symbol eines Elements abgelesen werden. Das Element hat einen vollständigen Namen, wie beispielsweise „Sauerstoff“, und ein internationales Kurzsymbol, in diesem Fall „O“.
Diese Symbole bestehen meist aus einem oder zwei Buchstaben und sind international standardisiert, um eine einfache Erkennung zu gewährleisten. Die Verwendung von Symbolen erleichtert die Kommunikation über Elemente zwischen Wissenschaftlern und Fachleuten unterschiedlicher Sprachen.
H steht zum Beispiel für Wasserstoff, während Fe für Eisen steht. Diese Symbole sind nicht immer intuitiv, besonders wenn sie auf lateinischen Namen basieren. Daher ist es nützlich, mit den gebräuchlichsten Symbolen vertraut zu sein.
Der Name des Elements gibt weitere Einblicke in seine Eigenschaften und seinen historischen Hintergrund. Zum Beispiel wurde Kupfer (Cu) vom lateinischen Wort „cuprum“ abgeleitet, was „von der Insel Zypern stammend“ bedeutet.
Die Kombination von Name und Symbol ist also essenziell für das Verständnis der chemischen Elemente und ihre Platzierung im Periodensystem. Es ermöglicht eine schnelle Identifikation und vereinfacht komplexe wissenschaftliche Diskussionen und Dokumentationen erheblich.
Das Periodensystem ist eine Sprache der Natur, die von Wissenschaftlern weltweit verstanden und gesprochen wird. – Dmitri Mendelejew
| Elementname | Symbol |
|---|---|
| Sauerstoff | O |
| Wasserstoff | H |
| Eisen | Fe |
| Kupfer | Cu |
Ordnungszahl
Im Periodensystem ist die Ordnungszahl ein grundlegender Aspekt, den man sofort ablesen kann. Sie gibt die Anzahl der Protonen im Atomkern eines Elements an und bestimmt somit auch seine Position im Periodensystem. Elemente sind nach steigender Ordnungszahl geordnet, was bedeutet, dass sie mit jedem Schritt ein weiteres Proton im Kern haben.
Die Ordnungszahl ist entscheidend, weil sie die chemischen Eigenschaften eines Elements in hohem Maße beeinflusst.
Ein Element wie Wasserstoff hat beispielsweise die Ordnungszahl 1, da es nur ein Proton im Kern besitzt. Helium hingegen weist zwei Protonen auf und hat daher die Ordnungszahl 2. Dieser Unterschied führt zu stark variierenden physikalischen und chemischen Charakteristiken zwischen den beiden.
Der Wert der Ordnungszahl findet sich meist gut sichtbar über dem Elementsymbol im Periodensystem. Dies macht es einfach, verschiedene Elemente untereinander zu vergleichen und ihre Stellung innerhalb der Tabelle zu erkennen.
Durch die Ordnungszahl lässt sich auch die Zugehörigkeit eines Elements zur jeweiligen Gruppe und Periode ableiten. Somit bietet die Ordnungszahl einen schnell zugänglichen Überblick über fundamentale Informationen jedes Elements.
| Elementname | Symbol | Ordnungszahl |
|---|---|---|
| Sauerstoff | O | 8 |
| Wasserstoff | H | 1 |
| Eisen | Fe | 26 |
| Kupfer | Cu | 29 |
Atommasse
Die Atommasse eines Elements ist ein wichtiger Wert, der im Periodensystem abgelesen werden kann. Sie gibt an, wie viel ein Atom des jeweiligen Elements im Durchschnitt wiegt. Dabei handelt es sich um einen gemittelten Wert, da die meisten Elemente in natürlichen Vorkommen mehrere Isotope haben.
Isotope sind Varianten eines Elements mit unterschiedlicher Neutronenzahl und daher leicht unterschiedlichen Massen. So ergibt sich die Atommasse als gewichteter Mittelwert dieser Isotope, basierend auf ihrer relativen Häufigkeit. Ein praktisches Beispiel hierfür ist das Kohlenstoffatom, das hauptsächlich aus den Isotopen C-12 und C-13 besteht.
Die Atommasse wird üblicherweise in u (unit) angegeben, was einer atomaren Masseneinheit entspricht. Diese Einheit basiert auf dem zwölften Teil der Masse eines Kohlenstoff-12-Atoms. Die Angabe der Atommasse hilft nicht nur bei chemischen Berechnungen, sondern auch beim Verständnis der physikalischen Eigenschaften von Elementen.
Wenn man die Atommasse eines gegebenen Elements kennt, ist es möglich, die Stoichiometrie verschiedener chemischer Reaktionen genau zu berechnen. Damit unterstützt die Atommasse Fachleute und Lernende in zahlreichen wissenschaftlichen Disziplinen dabei, präzise experimentelle Ergebnisse zu erzielen.
Elektronenkonfiguration
Die Elektronenkonfiguration eines Elements gibt die Verteilung der Elektronen auf die verschiedenen Atomshells und Orbitale an. Diese Information ist entscheidend für das Verständnis der chemischen Eigenschaften eines Elements, wie Reaktivität und Bindungsverhalten.
Jedes Element hat eine spezifische Elektronenkonfiguration, die in einer bestimmten Reihenfolge gefüllt wird, beginnend bei den energieniedrigeren Niveaus. Die Konfiguration wird durch Zahlen und Buchstaben dargestellt, z.B. 1s² 2s² 2p⁶ für Neon. Hierbei steht ‚1‘ für die erste Schale, ’s‘ für die Art des Orbitals und die hochgestellte Zahl ‚2‘ für die Anzahl der Elektronen in diesem Orbital.
Durch die Elektronenkonfiguration kann man auch Rückschlüsse auf das chemische Verhalten und die Anordnung im Periodensystem ziehen. Elemente, die sich in derselben Gruppe befinden, haben oft ähnliche äußere Elektronenverteilungen. So weisen beispielsweise alle Edelgase eine komplett gefüllte äußere Schale auf, was sie besonders stabil und reaktionsträge macht.
Ein tiefes Verständnis der Elektronenkonfiguration erleichtert es, vorherzusagen und zu erklären, warum bestimmte Elemente in bestimmten chemischen Reaktionen auftreten oder nicht. Dies ist von zentraler Bedeutung für die Chemie und viele angewandte Wissenschaften.
Das Periodensystem – einfach erklärt – REMAKE
Video-Link: https://www.youtube.com/watch?v=lsVL6Bg4Y9U
Gruppenzugehörigkeit
Im Periodensystem sind die Elemente in vertikalen Spalten angeordnet, die als Gruppen bezeichnet werden. Diese Gruppen enthalten Elemente mit ähnlichen chemischen Eigenschaften, da sie die gleiche Anzahl an Elektronen in ihren äußersten Schalen besitzen.
Die Hauptgruppen des Periodensystems sind nummeriert von 1 bis 18. So finden Sie zum Beispiel die Alkalimetalle in der Gruppe 1, während die Edelgase in der Gruppe 18 zu finden sind.
Alkalimetalle (z.B. Lithium, Natrium) sind bekannt für ihre hohe Reaktivität und Metallglanz, während Edelgase (z.B. Helium, Neon) extrem reaktionsträge sind und oft in Leuchtstoffröhren verwendet werden.
Die Gruppenzugehörigkeit eines Elements gibt Aufschluss über seine chemischen Bindungseigenschaften und mögliche Reaktionspartner. Zudem kann man dadurch Vorhersagen über das Verhalten dieser Elemente unter bestimmten Bedingungen treffen.
Ein weiteres interessantes Merkmal ist die Verwendung der Nebengruppen, die Übergangsmetalle wie Eisen, Kupfer und Gold beinhalten. Diese zeigen eine große Vielfalt in ihrer Elektronenkonfiguration, was ihnen einzigartige physikalische und chemische Eigenschaften verleiht.
Aggregatzustand
Der Aggregatzustand eines Elements ist ein wichtiges Merkmal, das aus dem Periodensystem abgelesen werden kann. Er beschreibt die Erscheinungsform des Elements bei Raumtemperatur und normalem Atmosphärendruck.
Die gängigsten Aggregatzustände sind fest, flüssig und gasförmig. Sie werden oft durch verschiedene Farben oder Symbole im Periodensystem gekennzeichnet, was eine schnelle Identifikation ermöglicht. Wasserstoff (H) beispielsweise liegt unter normalen Bedingungen als Gas vor, während Eisen (Fe) in fester Form existiert.
Einige Elemente, wie Quecksilber (Hg), haben spezielle Zustände; Quecksilber ist nämlich einer der wenigen Stoffe, der bei Raumtemperatur flüssig ist. Solche Informationen sind nützlich für chemische Reaktionen und industrielle Anwendungen, da sie die Handhabung und Lagerung der Elemente beeinflussen.
Beim Blick ins Periodensystem hilft das Wissen über den Aggregatzustand auch dabei, Rückschlüsse auf intermolekulare Kräfte zu ziehen. Elemente, die bei Raumtemperatur fest sind, neigen dazu, starke Bindungen zwischen ihren Atomen oder Molekülen auszubilden. Gase hingegen weisen schwächere intermolekulare Kräfte auf.
Durch Verständnis dieser Zustände wird deutlich, wie vielfältig die Welt der Chemie ist. Das Periodensystem bietet somit nicht nur eine Übersicht über die Elemente selbst, sondern auch über deren physikalische Eigenschaften.