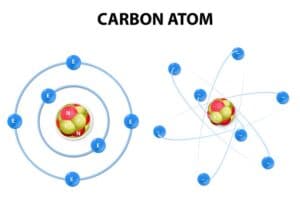
Das Periodensystem der Elemente ist ein leistungsfähiges Werkzeug, um die chemischen Eigenschaften und Verhaltensweisen der verschiedenen Atome zu organisieren. Ein wesentlicher Bestandteil dieses Systems sind die Hauptgruppen, die Elemente basierend auf ihrer Elektronenkonfiguration und ähnlichen chemischen Eigenschaften kategorisieren.
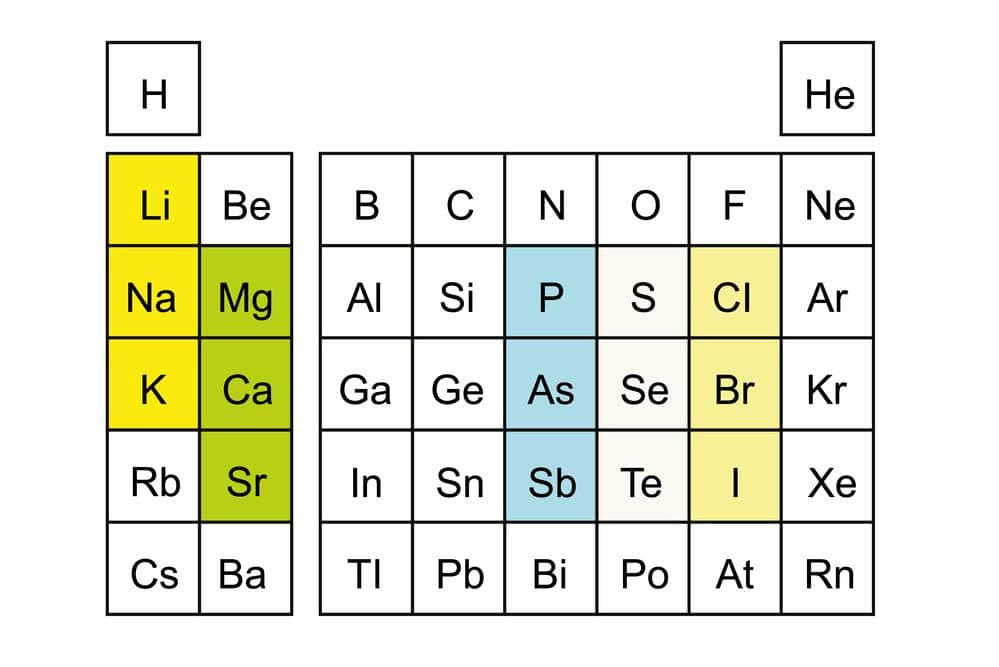
Zu den Hauptgruppen zählen unter anderem die Gruppe 1 (die Alkalimetalle), Gruppe 2 (die Erdalkalimetalle), Gruppe 17 (die Halogene) und Gruppe 18 (die Edelgase). Diese Gruppierung ermöglicht es Wissenschaftler:innen und Chemieliebhaber:innen gleichermaßen, Trends in den chemischen Eigenschaften leicht nachzuvollziehen und Vorhersagen über Reaktionen und Bindungen zu treffen.
Die Kenntnis dieser Hauptgruppen hilft nicht nur dabei, das Verhalten von Elementen im Alltag besser zu verstehen, sondern auch bei der Entwicklung neuer Materialien und Technologien. Sie dienen als Leitfaden für viele Anwendungen und Forschungsbereiche innerhalb der Chemie und darüber hinaus.
Das Wichtigste in Kürze
- Hauptgruppen im Periodensystem kategorisieren Elemente nach ähnlichen chemischen Eigenschaften.
- Alkalimetalle (Gruppe 1) sind hochreaktiv, besonders mit Wasser.
- Erdalkalimetalle (Gruppe 2) sind weniger reaktionsfreudig, aber immer noch relativ aktiv.
- Halogene (Gruppe 17) sind sehr reaktiv und bilden Salze.
- Edelgase (Gruppe 18) sind reaktionsträge, farblos und geruchlos.
Hauptgruppen im Periodensystem: Elemente mit ähnlichen Eigenschaften
Im Periodensystem der Elemente werden die chemischen Elemente in Hauptgruppen eingeteilt, die sich durch ähnliche chemische und physikalische Eigenschaften auszeichnen. Diese Gruppen sind besonders wichtig, da sie ein systematisches Verständnis der reaktiven und strukturellen Eigenschaften von Elementen ermöglichen.
Die Elemente jeder Hauptgruppe zeigen charakteristische Muster bei ihrer Reaktionsfreudigkeit und ihren Verbindungen mit anderen Stoffen. So reagieren beispielsweise die Alkalimetalle der Gruppe 1 sehr stark mit Wasser, während die Edelgase der Gruppe 18 äußerst träge und stabil sind. Das gemeinsame Merkmal dieser Gruppen ist die Anzahl der Valenzelektronen, was einen direkten Einfluss auf ihre chemischen Verhalten hat.
Ein weiterer wichtiger Aspekt ist die Beobachtung periodischer Trends innerhalb einer Gruppe. Beispielsweise nimmt die Reaktivität der Alkalimetalle von oben nach unten zu. Ähnlich verhält es sich mit den Halogenen in Gruppe 17, deren Eigenschaft als starke Oxidationsmittel von Fluor bis Iod abnimmt.
Durch das Studium der Hauptgruppen im Periodensystem kann man also fundierte Aussagen über die typischen Reaktionen und Nutzungsmöglichkeiten der jeweiligen Elemente treffen. Dies unterstreicht die Bedeutung der Systematik des Periodensystems für Chemiker und andere Naturwissenschaftler.
Das Periodensystem der Elemente ist wie eine Landkarte im Reich der Chemie, es zeigt uns Geographie und Topographie unserer molekularen Welt. – Dmitri Mendelejew
| Hauptgruppen | Besondere Eigenschaften |
|---|---|
| Gruppe 1: Alkalimetalle | Reagieren stark mit Wasser |
| Gruppe 2: Erdalkalimetalle | Weniger reaktionsfreudig als Alkalimetalle |
| Gruppe 17: Halogene | Sehr reaktiv, bilden Salze |
| Gruppe 18: Edelgase | Reaktionsträge, farblos und geruchlos |
Gruppe 1: Alkalimetalle, reagieren stark mit Wasser
Gruppe 1: Alkalimetalle, reagieren stark mit Wasser
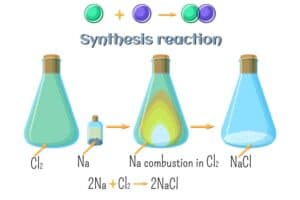
Die Elemente der Gruppe 1 im Periodensystem sind als Alkalimetalle bekannt. Diese Gruppe beinhaltet bekannte Elemente wie Natrium (Na) und Kalium (K). Alkalimetalle zeichnen sich durch ihre hohe Reaktivität aus, insbesondere in Kontakt mit Wasser.
Wenn ein Alkalimetall auf Wasser trifft, kommt es zu einer heftigen chemischen Reaktion. Dabei entsteht Wasserstoffgas (H2) und eine alkalische Lösung, die aus dem entsprechenden Hydroxid des Metalls besteht. Zum Beispiel reagiert Natrium mit Wasser unter Bildung von Natriumhydroxid (NaOH) und Wasserstoffgas.
Diese Reaktionen verlaufen oft so heftig, dass sie auch kleine Explosionen hervorrufen können. Aus diesem Grund werden Alkalimetalle in Laboren häufig unter Öl aufbewahrt, um den Kontakt mit Luftfeuchtigkeit und Wasser zu vermeiden.
Neben ihrer Reaktionsfreudigkeit haben Alkalimetalle weitere gemeinsame Eigenschaften. Sie sind äußerst weich und können leicht mit einem Messer geschnitten werden. Außerdem verfügen sie über einen niedrigen Schmelzpunkt und sind ausgezeichnete elektrische Leiter.
Zusammengefasst, macht diese Kombination von hoher Reaktivität und spezifischen physikalischen Eigenschaften die Alkalimetalle sehr interessant für unterschiedlichste Anwendungen, was jedoch immer Vorsicht im Umgang erfordert.
| Gruppe | Elementbeispiele | Reaktionsverhalten |
|---|---|---|
| Gruppe 1: Alkalimetalle | Lithium, Natrium, Kalium | Reagieren heftig mit Wasser, bilden starke Basen |
| Gruppe 2: Erdalkalimetalle | Calcium, Magnesium, Beryllium | Reaktionsfreudig, aber weniger heftig als Alkalimetalle |
| Gruppe 17: Halogene | Fluor, Chlor, Brom | Sehr reaktiv, neigen zur Bildung von Salzen |
Gruppe 2: Erdalkalimetalle, weniger reaktionsfreudig als Alkalimetalle
Erdalkalimetalle sind die Elemente der Gruppe 2 des Periodensystems. Sie sind im Vergleich zu den Alkalimetallen weniger reaktionsfreudig, trotzdem zeigen sie eine bemerkenswerte Reaktivität, speziell bei höheren Temperaturen. Zu dieser Gruppe gehören Beryllium (Be), Magnesium (Mg), Calcium (Ca), Strontium (Sr), Barium (Ba) und Radium (Ra).
Magnesium und Calcium sind besonders bekannt für ihre Anwendung in verschiedenen Industrien. Beispielsweise wird Magnesium häufig in Leichtbau-Materialien eingesetzt, während Calcium als Bestandteil von Beton und Zement verwendet wird. Diese Metalle reagieren zwar langsamer mit Wasser als Alkalimetalle, bilden aber dennoch Hydroxide und Wasserstoffgas.
Ein weiteres interessantes Merkmal der Erdalkalimetalle ist ihre Härte und der höhere Schmelzpunkt im Vergleich zu den weicheren Alkalimetallen. Dies liegt an den stärkeren metallischen Bindungen innerhalb ihrer Kristallstrukturen.
Alle Erdalkalimetalle besitzen typisch metallische Eigenschaften wie hohe elektrische Leitfähigkeit und glänzende Oberflächen. Während Beryllium und Magnesium eher eine geringe Dichte aufweisen, sind Calcium, Strontium, Barium und Radium dichtere Metalle.
Zusammengefasst bieten die Erdalkalimetalle wichtige Materialien und Chemikalien für diverse Anwendungsbereiche, auch wenn sie etwas weniger spektakulär reagieren als ihre Nachbarn aus der ersten Hauptgruppe.
Gruppe 17: Halogene, sehr reaktiv, bilden Salze
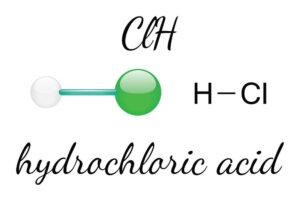
Gruppe 17 besteht aus den Halogenen, welche für ihre hohe Reaktivität bekannt sind. Diese Elemente reagieren besonders intensiv mit Metallen und bilden dabei Salze. Ein bekanntes Beispiel hierfür ist Kochsalz, welches chemisch als Natriumchlorid (NaCl) bezeichnet wird.
Ein wesentlicher Aspekt der Halogene ist ihr großer Drang, Elektronen aufzunehmen und so in Verbindungen stabile Elektronenkonfigurationen zu erreichen. Dies führt dazu, dass sie oft in natürlichen Vorkommen als Teil von Salzen gefunden werden und nie in ihrer elementaren Form vorliegen.
Die Halogene umfassen fünf Elemente: Fluor (F), Chlor (Cl), Brom (Br), Iod (I) und Astat (At). Alle diese Elemente sind hoch reaktiv, aber ihre Reaktivität nimmt innerhalb der Gruppe ab. Das heißt, Fluor ist das reaktivste Element dieser Gruppe, während Astat am wenigsten reaktiv ist.
Ein weiterer bemerkenswerter Punkt ist die Vielfalt der physikalischen Zustände unter diesen Elementen. Während Fluor und Chlor Gase sind, kommt Brom als Flüssigkeit und Iod sowie Astat als Feststoffe vor. Dieses Merkmal verdeutlicht die unterschiedlichen physikalischen Eigenschaften trotz ihrer chemischen Ähnlichkeiten.
Zusammenfassend lässt sich sagen, dass die Halogene eine faszinierende Gruppe im Periodensystem darstellen, deren stark ausgeprägte Reaktivität und Fähigkeit zur Salzbildung wichtige Rollen in vielen chemischen Prozessen spielen.
Video: Periodensystem Hauptgruppen│Chemie Lernvideo [Learning Level Up]
Video-Link: https://www.youtube.com/watch?v=_E0ALmyo5sY
Gruppe 18: Edelgase, reaktionsträge, farblos und geruchlos
Edelgase bilden die Gruppe 18 im Periodensystem. Sie sind bekannt dafür, dass sie reaktionsträge sind, was bedeutet, dass sie unter normalen Bedingungen kaum an chemischen Reaktionen teilnehmen. Diese Eigenschaften machen sie unglaublich nützlich in zahlreichen Anwendungen, bei denen eine nicht-reaktive Umgebung benötigt wird.
Ein typisches Merkmal der Edelgase ist ihre Farblosigkeit und ihr Fehlen von Geruch. Zu den bekannten Vertretern zählen Helium, Neon, Argon, Krypton, Xenon und Radon. Besonders Helium hat aufgrund seiner Leichtigkeit und Nichtentzündlichkeit einen hohen Stellenwert, beispielsweise in der Medizin und bei der Herstellung von Schutzatmosphären.
Ihre stabile Elektronenkonfiguration bedeutet, dass sie nur selten Verbindungen mit anderen Elementen eingehen. Dies resultiert aus ihrer vollen Außenschale von Elektronen, was ihnen eine extrem stabile Struktur verleiht. Trotz ihrer Stabilität und Reaktionsträgheit werden Edelgase unter bestimmten extremen Bedingungen durchaus reaktiv und können Verbindungen wie Xenonfluorid bilden.
Die Nutzung dieser einzigartigen Elemente reicht von Lichtquellen (z.B. Neonlichter) bis hin zur Kühlung in Hochleistungsumgebungen durch flüssiges Helium. Die vielfältigen Anwendungen zeigen die Universalität dieser scheinbar unscheinbaren Elemente.
Insgesamt tragen die besonderen Attribute der Edelgase dazu bei, dass sie in vielen Bereichen unverzichtbar sind, sei es in der Industrie, Forschung oder im alltäglichen Leben.
Periodizität und Trends in Hauptgruppen beobachten
Im Periodensystem der Elemente zeigt sich eine deutliche Periodizität, die das Verhalten und die Eigenschaften der Hauptgruppenelemente beeinflusst. Diese Periodizität basiert auf der Anordnung der Elektronen in den Atomen, speziell in den äußeren Schalen.
Ein wesentlicher Trend ist die Änderung des Atomradius. Innerhalb einer Gruppe nimmt der Atomradius von oben nach unten zu, da mit jeder Periode eine neue Elektronenschale hinzugefügt wird. Dadurch befinden sich die Außenelektronen weiter entfernt vom Kern.
Ein weiterer wichtiger Aspekt sind die Ionenisierungsenergien. Diese Energien nehmen innerhalb einer Gruppe von oben nach unten ab, weil die Außenelektronen immer weniger stark vom Atomkern angezogen werden und somit leichter entfernt werden können.
Zusätzlich ändert sich der reaktive Charakter der Elemente entlang der Gruppen. Beispielsweise sind Alkalimetalle (Gruppe 1) sehr reaktiv und reagieren leicht mit Wasser, wobei die Reaktivität von oben nach unten zunimmt. Im Gegensatz dazu sind Edelgase (Gruppe 18) äußerst stabil und inert, was bedeutet, dass ihre Reaktivität minimal ist.
Diese Trends helfen dabei zu verstehen, warum Elemente bestimmter Gruppen ähnliche chemische und physikalische Eigenschaften aufweisen.