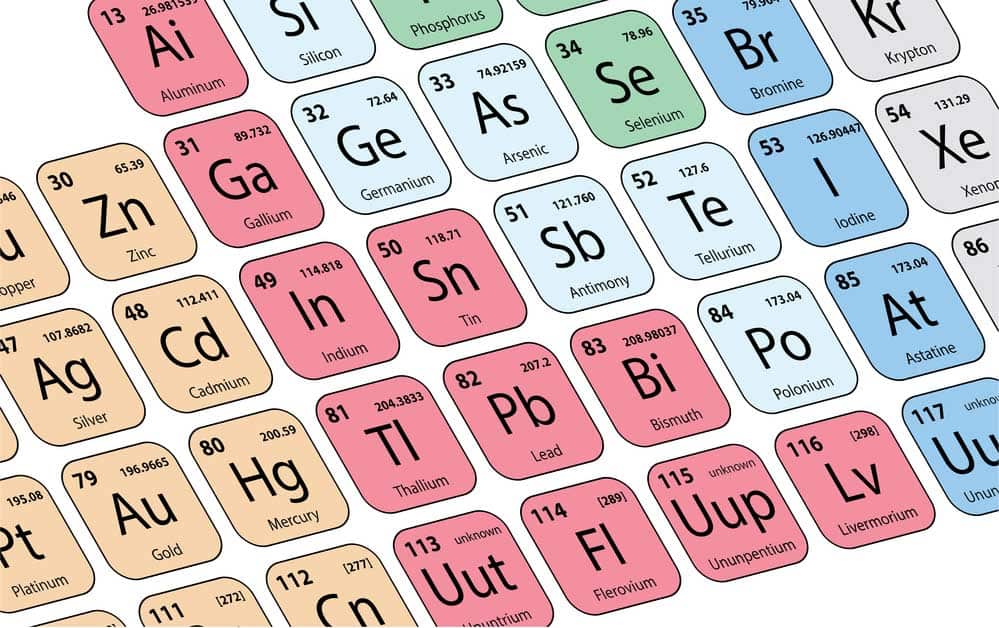
Das Periodensystem der Elemente dient als fundamentales Werkzeug in der Chemie. Es ordnet die chemischen Elemente nach steigender Ordnungszahl und ähnlichen Eigenschaften. Haupt- und Nebengruppen spielen hierbei eine zentrale Rolle, indem sie Elemente mit gemeinsamen Merkmalen gruppieren. Diese Struktur hilft nicht nur bei der Identifikation der Eigenschaften einzelner Elemente, sondern ermöglicht es auch, deren Reaktivität vorherzusagen.
Hauptgruppenelemente haben ähnliche Valenzelektronen und zeigen daher vergleichbare chemische Reaktionen. Im Gegensatz dazu umfassen die Nebengruppen die sogenannten Übergangsmetalle, die durch variable Oxidationsstufen gekennzeichnet sind. Die klare Aufteilung des Periodensystems erleichtert somit das Verständnis von Elementverhalten und trägt zur systematischen Forschung in der Chemie sowie zu zahlreichen industriellen Anwendungen bei.
Das Wichtigste in Kürze
- Das Periodensystem ordnet Elemente nach steigender Ordnungszahl und ähnlichen Eigenschaften.
- Hauptgruppen zeigen ähnliche Valenzelektronen und chemische Reaktionen auf.
- Nebengruppen umfassen Übergangsmetalle mit variablen Oxidationsstufen.
- Periodische Trends ermöglichen Vorhersagen über das Verhalten von Elementen.
- Zahlreiche industrielle und chemische Anwendungen basieren auf spezifischen Elementeigenschaften.
Ordnung durch chemische Eigenschaften der Elemente
Das Periodensystem der Elemente ist ein zentrales Werkzeug in der Chemie. Es ordnet alle bekannten chemischen Elemente nach steigender Protonenzahl und gruppiert sie anhand ihrer chemischen Eigenschaften.
Eine wesentliche Grundlage für die Ordnung im Periodensystem sind die chemischen Eigenschaften der Elemente. Diese Eigenschaften ähneln sich innerhalb bestimmter Gruppen, weil die Elemente eine ähnliche Anzahl von Valenzelektronen besitzen. Dies führt zu ähnlichem Verhalten bei Reaktionen und ähnlicher Reaktivität.
In den Hauptgruppen teilen sich die Elemente nicht nur die Anzahl der Valenzelektronen, sondern auch charakteristische Reaktionsmuster. So reagieren zum Beispiel die Alkalimetalle (1. Hauptgruppe) sehr heftig mit Wasser und bilden dabei Hydroxide und Wasserstoffgas.
Die Nebengruppen hingegen umfassen die sogenannten Übergangsmetalle. Diese zeichnen sich durch ihre vielseitigen Oxidationsstufen aus, was ihnen unterschiedliche Reaktionsmöglichkeiten verleiht. Ein bekanntes Übergangsmetall ist Eisen, das sowohl in der Oxidationsstufe +2 als auch +3 vorkommen kann.
Durch diese systematische Anordnung können Chemiker leicht Vorhersagen über das chemische Verhalten neuer oder noch nicht vollständig erforschter Elemente treffen. Das Periodensystem bietet somit eine wertvolle Struktur zur Klassifizierung und Untersuchung der großartigen Vielfalt an chemischen Substanzen.
Die Anordnung der chemischen Elemente im Periodensystem erlaubt uns, die chemischen Verbindungen und deren Reaktionen tiefgehend zu verstehen. – Dmitri Mendelejew
| Eigenschaftsgruppe | Merkmale |
|---|---|
| Hauptgruppen | Ähnliche Valenzelektronen und chemische Reaktionen |
| Nebengruppen | Übergangsmetalle mit variabler Oxidationsstufe |
Video: Nebengruppen im Periodensystem
Video-Link: https://www.youtube.com/watch?v=F4f7xQ82UXQ
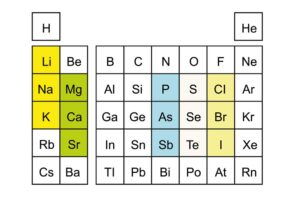
Hauptgruppen: ähnliche Reaktivität und Valenzelektronen
Ein bemerkenswertes Merkmal des Periodensystems ist die Gruppierung von Elementen in Hauptgruppen. Diese Gruppeneinteilung bringt Ordnung und Übersichtlichkeit in die Vielzahl der Elemente.
Hauptgruppen zeichnen sich durch ähnliche chemische Eigenschaften aus, insbesondere was ihre Reaktivität angeht. Die Elemente innerhalb einer Hauptgruppe zeigen oft vergleichbare Verhaltensweisen bei chemischen Reaktionen. Dies liegt an der Anordnung ihrer Elektronen.
Insbesondere haben die Atome der Hauptgruppenelemente eine ähnliche Anzahl von Valenzelektronen. Valenzelektronen sind die Elektronen in der äußersten Schale eines Atoms und spielen eine entscheidende Rolle bei chemischen Bindungen. Zum Beispiel hat jedes Element der ersten Hauptgruppe, auch bekannt als Alkalimetalle, ein einziges Valenzelektron. Dieses Valenzelektron beeinflusst stark ihre chemische Reaktivität und macht sie außergewöhnlich reaktionsfreudig, besonders mit Halogenen oder Wasser.
Gleiches gilt für andere Hauptgruppen wie die Halogene (7. Gruppe), die sieben Valenzelektronen besitzen und daher meist sehr leicht Elektronen aufnehmen können, um Edelgaskonfiguration zu erreichen. Ähnlichkeiten in der Elektronenanordnung ermöglichen es Chemikern, das Verhalten neuer oder weniger bekannter Elemente vorauszusagen und machen das Studium der Chemie systematisch und logischer.
| Gruppe | Valenzelektronen | Reaktionsverhalten |
|---|---|---|
| Alkalimetalle | 1 | Sehr reaktiv mit Wasser |
| Halogene | 7 | Stark reaktiv mit Metallen |
| Edelgase | 8 | Reaktionsträge |
Nebengruppen: Übergangsmetalle mit variabler Oxidationsstufe
Die Nebengruppen des Periodensystems umfassen die sogenannten Übergangsmetalle. Diese Elemente zeichnen sich durch ihre variable Oxidationsstufe aus, was bedeutet, dass sie je nach chemischer Umgebung verschiedene Elektronenzahlen abgeben oder aufnehmen können. Dies führt zu einer Vielzahl von Verbindungen und es ermöglicht diesen Metallen, in vielen unterschiedlichen chemischen Reaktionen nützlich zu sein.
Ein typisches Merkmal der Übergangsmetalle ist ihre Fähigkeit, stabile Komplexe mit Liganden zu bilden. Diese Komplexe spielen eine zentrale Rolle in verschiedenen Bereichen wie der Katalyse, der Biochemie und der Materialwissenschaft.
Ein weiteres faszinierendes Attribut der Übergangsmetalle ist ihre unterschiedliche Farbe, die oft auf den d-d-Übergang ihrer Elektronen zurückzuführen ist. Dadurch sind diese Elemente häufig in Farbstoffen und Pigmenten vertreten.
Im täglichen Leben begegnen uns Übergangsmetalle in zahlreichen Formen, etwa als Eisen in der Stahlproduktion, Kupfer in elektrischen Leitungen oder Titan in leichten, aber starken Legierungen für Luft- und Raumfahrtanwendungen.
Von besonderer Bedeutung ist auch ihre Funktion in biologischen Systemen. Beispielsweise ist Eisen ein Schlüsselbestandteil des Hämoglobins, das für den Sauerstofftransport im Blut unverzichtbar ist.
Die Fähigkeit der Übergangsmetalle, verschiedene Oxidationsstufen einzunehmen, macht sie zu einem äußerst vielseitigen Bestandteil des Periodensystems und eröffnet zahlreiche Anwendungsmöglichkeiten in Wissenschaft und Technik.
Periodische Systematik und Vorhersage von Elementverhalten
Eine der bemerkenswertesten Eigenschaften des Periodensystems ist seine Fähigkeit zur _Vorhersage_ des Verhaltens von Elementen. Dies basiert auf den regelmäßigen Mustern oder _Periodizitäten_, die bei der Untersuchung unterschiedlicher Elemente festgestellt wurden. Die Position eines Elements im Periodensystem kann wertvolle Informationen über dessen chemische und physikalische Eigenschaften liefern.
Ein essentielles Konzept dabei sind die Valenzelektronen. Diese Elektronen bestimmen maßgeblich, wie ein Atom mit anderen Atomen reagiert. In den Hauptgruppen findet man ähnliche Reaktivitäten aufgrund vergleichbarer Valenzelektronenstrukturen vor. Zum Beispiel neigen Elemente der 1. Hauptgruppe dazu, leicht ein Elektron abzugeben, während Elemente der 17. Hauptgruppe typischerweise ein Elektron aufnehmen.
Bei den Nebengruppen hingegen spielen _Übergangsmetalle_ eine wichtige Rolle. Sie zeigen variable Oxidationsstufen und besitzen die Fähigkeit, in verschiedenen Arten stabiler Verbindungen aufzutreten. Diese variablen Oxidationszustände eröffnen vielfältige Möglichkeiten für chemische Reaktionen und machen Übergangsmetalle besonders nützlich in Katalyseprozessen.
Die periodische Systematik ermöglicht es auch, Trends innerhalb einer Gruppe (senkrecht) oder Periode (waagerecht) zu erkennen. Man beobachtet zum Beispiel, dass der Atomradius innerhalb einer Gruppe zunimmt, je weiter man nach unten kommt. Ebenso nimmt die Elektronegativität tendenziell ab.
Diese systematische Ordnung erlaubt es Wissenschaftlerinnen und Wissenschaftlern, Eigenschaften neuer oder unbekannter Elemente vorherzusagen, basierend auf ihrem Platz im Periodensystem. So wurde bereits mehrfach genau gesagt, welche Eigenschaften ein noch zu entdeckendes Element haben könnte, bevor es schließlich isoliert werden konnte.
Video: HAUPT- UND NEBENGRUPPENELEMENTE | Chemie | Modelle, Formeln und Konzepte
Video-Link: https://www.youtube.com/watch?v=IZcw2HYZDIs
Anwendungsbeispiele in Chemie und Industrie
Chemische Elemente haben zahlreiche Anwendungsbereiche in der Chemie und Industrie. Unter anderem wird Wasserstoff aufgrund seiner hohen Energiedichte als alternativer Brennstoff und für die Herstellung von Ammoniak verwendet.
Silizium spielt eine zentrale Rolle in der Halbleiterindustrie, da es die Basis für Computerchips bildet. Eisen hingegen ist unverzichtbar in der Bau- und Automobilindustrie und wird zur Herstellung von Stahl genutzt.
Dank ihrer Eigenschaften sind mehrere Metalle der Nebengruppe wie Kupfer ideal für elektrische Leitungen, während Katalysatoren aus Platin und Palladium in der Chemie häufig eingesetzt werden, um Reaktionen zu beschleunigen.
Die Vielfalt der Anwendungsmöglichkeiten erstreckt sich auch auf seltener vorkommende Elemente. Zum Beispiel ist Lanthan in elektromagnetischen Bauteilen nützlich und wird bei der Fertigung hochspezialisierter optischer Linsen eingesetzt.
Zusätzlich spielen Elemente der Hauptgruppen wichtige Rollen in der Alltagspraxis. Natrium und Kalium sind essenziell für biologische Prozesse und finden in medizinischen Anwendungen Verwendung. Aluminium, das leicht und widerstandsfähig ist, wird vielfach im Flugzeugbau genutzt.
Diese Beispiele zeigen nur einen kleinen Teil davon, wie vielfältig und wichtig die chemischen Elemente sind. Ihre einzigartige Kombination an Eigenschaften ermöglicht es, moderne Technologien voranzutreiben und neue Produkte zu entwickeln.
Historische Entwicklung des Periodensystems
Das Periodensystem der Elemente hat eine spannende Geschichte, die im 19. Jahrhundert begann. Frühe Chemiker versuchten, Ordnung in die wachsende Zahl von Elementen zu bringen. Dabei stellten sie fest, dass sich die Eigenschaften der Elemente wiederholten, wenn diese nach ihren Atomgewichten geordnet wurden.
Der russische Chemiker Dmitri Mendelejew veröffentlichte 1869 ein Periodensystem, das den Grundstein für die moderne Version legte. Er ordnete die Elemente nicht nur nach ihren Atomgewichten, sondern erkannte auch das Gesetz der Periodizität: Ähnliche chemische Eigenschaften treten in regelmäßigen Abständen auf. Durch dieses System konnte er sogar vorhersehen, welche Eigenschaften noch unentdeckte Elemente haben würden.
Mendelejews Arbeit wurde später durch die Entdeckung von Protonen und Neutronen weiter verfeinert. Heute werden die Elemente nach ihrer Ordnungszahl – also der Anzahl der Protonen im Kern – sortiert. Diese Anpassung beseitigte Probleme, die bei der Anordnung nach Atomgewichten auftraten, da isotopische Unterschiede berücksichtigt wurden.
Insgesamt zeigt die historische Entwicklung des Periodensystems, wie wissenschaftlicher Fortschritt durch Beobachtung und systematische Analyse erreicht wird. Das Periodensystem bleibt bis heute ein zentrales Werkzeug in der Chemie und hilft Wissenschaftlern rund um den Globus, die Geheimnisse der Materie zu entschlüsseln und neue Materialien zu entwickeln.