Einfache chemische Reaktionen
Eine chemische Reaktion stellt einen fundamentalen Prozess dar, bei dem eine oder mehrere Substanzen in neue Produkte umgewandelt werden. Hierbei ist es entscheidend, die Reaktionsmechanismen und möglichen Zwischenschritte zu verstehen. Dies erlaubt es uns, präzise stöchiometrische Berechnungen durchzuführen.
Simplere chemische Reaktionen wie das Rosten von Eisen oder die Neutralisation einer Säure mit einer Base verdeutlichen, wie sich Stoffe auf molekularer Ebene verändern. Generell muss genügend Energie zugeführt werden, um die ‚Aktivierungsenergie zu verringern‚ und so die Reaktion in Gang zu setzen. Sicherheitsmaßnahmen, wie das Tragen von Schutzbrillen und Handschuhen, sind währenddessen stets zu beachten.
Das Wichtigste in Kürze
- Chemische Reaktionen wandeln Edukte in neue Produkte um und ändern deren chemische Eigenschaften.
- Reaktionsmechanismen und Zwischenschritte bestimmen den genauen Ablauf und die Geschwindigkeit von Reaktionen.
- Stöchiometrische Berechnungen helfen, Mengenverhältnisse von Reaktanten und Produkten zu ermitteln.
- Wichtige Reaktionsbedingungen: Temperatur, Druck, Konzentration, Katalysatoren und Lösungsmittel.
- Sicherheitsmaßnahmen: Tragen von Schutzkleidung, Gefährdungsbeurteilung und Notfallausrüstung.
Ein Beispiel für eine einfache chemische Reaktion ist die Verbrennung von Kohle, bei der Kohlenstoff mit Sauerstoff reagiert und Kohlendioxid freisetzt. Eine weitere Reaktion ist die Rostbildung an Eisen, bei der Eisen mit Sauerstoff und Wasser reagiert und Eisenoxid bildet. Außerdem kann die Neutralisation von Essigsäure mit Natronlauge genannt werden, wobei Essigsäure und Natronlauge zu Natriumacetat und Wasser reagieren.
Definition der chemischen Reaktion
Eine chemische Reaktion beschreibt den Vorgang, bei dem aus Ausgangsstoffen, auch Edukte genannt, neue Stoffe mit anderen chemischen Eigenschaften entstehen. Während dieser Prozesse werden die Bindungen der Atome in den Edukten aufgebrochen und neu gebildet, wodurch Produkte entstehen.
Reaktionsgleichungen verdeutlichen diesen Prozess, indem sie symbolisch darstellen, wie die Anzahl der Atome jeder Art vor und nach der Reaktion gleich bleibt. Dies steht im Einklang mit dem Gesetz der Erhaltung der Masse. Ein einfaches Beispiel für eine chemische Reaktion ist die Bildung von Wasser aus Wasserstoff und Sauerstoff:
2 H2 + O2 → 2 H2O.
Ein wesentliches Merkmal von chemischen Reaktionen ist die Änderung der inneren Energie. Diese kann entweder freigesetzt oder aufgenommen werden, was sich als exotherm bzw. endotherm klassifizieren lässt. Exotherme Reaktionen setzen Wärme frei, während endotherme Reaktionen Energie aus der Umgebung aufnehmen.
Das Verstehen der Dynamik chemischer Reaktionen ermöglicht es uns auch zu wissen, wie wir „Chemische Reaktionen steuern“ können, um zielgerichtete Ergebnisse zu erzielen. Die Verringernung der Aktivierungsenergie, z. B. durch Katalysatoren, beschleunigt den Reaktionsablauf erheblich.
Da chemische Reaktionen allgegenwärtig sind – sei es beim Kochen, in der Industrie oder sogar in unserem Körper – spielt das Wissen darüber eine zentrale Rolle in vielen Bereichen des täglichen Lebens.
„Chemie ist die Brücke zwischen den Geisteswissenschaften und den Naturwissenschaften, sie zeigt, wie komplexe Phänomene durch einfache molekulare Prozesse erklärt werden können.“
– Linus Pauling
| Begriff | Erklärung |
|---|---|
| Reaktionsmechanismen | Beschreiben die detaillierten Schritte, durch die die Umwandlung von Edukten zu Produkten erfolgt. |
| Zwischenschritte | Die einzelnen Schritte oder Phasen, die während einer komplexen chemischen Reaktion auftreten. |
| Stöchiometrische Berechnungen | Mathematische Berechnungen, die verwendet werden, um die Verhältnisse der Reaktanten und Produkte zu ermitteln. |
Beispiele simpler chemischer Reaktionen
Ein einfaches Beispiel einer chemischen Reaktion ist die Verbrennung von Wasserstoff mit Sauerstoff, um Wasser zu bilden. Hier reagiert 2H2 (g) + O2 (g) zu 2H2O (l). Diese sogenannte Knallgasreaktion zeigt, wie zwei Gase unter Freisetzung von Energie (Reaktionswärme messen) ein Flüssigkeitsprodukt generieren können.
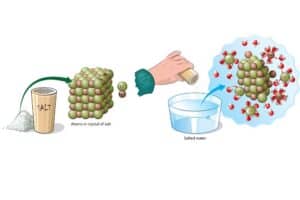
Eine weitere grundlegende Reaktion ist die Bildung von Kochsalz (Natriumchlorid), indem Natrium mit Chlor reagiert: 2Na (s) + Cl2 (g) → 2NaCl (s). In diesem Stöchiometrische Berechnungen spielen hierbei eine wichtige Rolle, um das Verhältnis der Reaktanten zu bestimmen.
Zusätzlich gibt es die Reaktion von Eisen mit Schwefel zur Bildung von Eisensulfid: Fe (s) + S (s) → FeS (s). Diese feste Produktherstellung ist darauf zurückzuführen, dass die beteiligten Elemente in einem festen Aggregatzustand zusammentreffen und reagieren.
Wenn wir über chemische Reaktionen sprechen, dürfen wir auch einfache Beispiele der Dissoziation nicht vergessen. Eine davon ist die Auflösung von Salzsäure in Wasser: HCl (aq) → H+ (aq) + Cl– (aq). Diese Art der Reaktion zeigt, wie Verbindungen in ihre Ionen zerfallen.
Diese simplen Reaktionen bieten einen ersten Einblick, wie Chemische Reaktionen steuern möglich ist. Sie dienen oft als Grundlage für komplexere Studien im Bereich der Chemie, wie etwa Zwischenschritte analysieren oder den Verlauf eines Reaktionsmechanismus besser zu verstehen.
| Begriff | Formel | Beschreibung |
|---|---|---|
| Reaktionsenthalpie | ΔH | Die Wärme, die bei einer chemischen Reaktion bei konstantem Druck abgegeben oder aufgenommen wird. |
| Gleichgewicht | Keq | Ein Zustand, in dem die Vorwärts- und Rückwärtsreaktionen einer chemischen Reaktion gleich schnell ablaufen. |
| Stoffmengenkonzept | n (mol) | Ein Konzept, das die Menge einer Substanz in Bezug auf die Anzahl der Teilchen beschreibt. |
Weitere Beispiele
- Verbrennung von Kohle
- Auflösen von Salz in Wasser
- Rostbildung an Eisen
- Bildung von Wasser durch Verbrennung von Wasserstoffgas
- Neutralisation von Essigsäure mit Natronlauge
- Herstellung von Essig durch Gärung von Wein
- Bildung von Kohlendioxid durch das Atmen von Tieren
- Verwitterung von Kalkstein durch Regenwasser
- Bildung von Sauerstoff beim Zerfall von Wasser
- Bildung von Ammoniak durch die Haber-Bosch-Synthese
| Chemische Reaktion | Elemente und genaue Reaktion | Ausgang | Reaktionsgleichung |
|---|---|---|---|
| Verbrennung von Kohle | Kohlenstoff + Sauerstoff -> Kohlendioxid | Emission von Kohlendioxid | C+O2→CO2C + O_2 \ → CO_2 |
| Auflösen von Salz in Wasser | Natriumchlorid + Wasser -> Natriumionen + Chloridionen | Bildung einer klaren Salzlösung | NaCl+H2O→Na++Cl−NaCl + H_2O \ → Na^+ + Cl^- |
| Rostbildung an Eisen | Eisen + Sauerstoff + Wasser -> Eisenoxid | Bildung von Rost | 4Fe+3O2+6H2O→4Fe(OH)34Fe + 3O_2 + 6H_2O \ → 4Fe(OH)_3 |
| Bildung von Wasser | Wasserstoff + Sauerstoff -> Wasser | Bildung von Wasser | 2H2+O2→2H2O2H_2 + O_2 \ → 2H_2O |
| Neutralisation von Essigsäure | Essigsäure + Natronlauge -> Natriumacetat + Wasser | Neutralisation der Essigsäure | CH3COOH+NaOH→CH3COONa+H2OCH_3COOH + NaOH \ → CH_3COONa + H_2O |
| Herstellung von Essig | Wein (Ethanol) -> Essig (Ethansäure) | Bildung von Essig | C2H5OH→C2H4O2C_2H_5OH \ → C_2H_4O_2 |
| Bildung von Kohlendioxid | Kohlensäure (im Blut) -> Kohlendioxid + Wasser | Abgabe von Kohlendioxid | H2CO3→CO2+H2OH_2CO_3 \ → CO_2 + H_2O |
| Verwitterung von Kalkstein | Kalkstein (Calciumcarbonat) + Regenwasser -> Calciumionen | Zersetzung des Kalksteins | CaCO3+H2O→Ca2++CO32−CaCO_3 + H_2O \ → Ca^{2+} + CO_3^{2-} |
| Bildung von Sauerstoff | Zerfall von Wasser -> Sauerstoff + Wasserstoff | Freisetzung von Sauerstoff | 2H2O→2H2+O22H_2O \ → 2H_2 + O_2 |
| Bildung von Ammoniak | Stickstoff + Wasserstoff -> Ammoniak | Entstehung von Ammoniak | N2+3H2→2NH3N_2 + 3H_2 \ → 2NH_3 |
Reaktionsbedingungen und Einflussfaktoren
Die Bedingungen, unter denen chemische Reaktionen ablaufen, spielen eine entscheidende Rolle für die Geschwindigkeit und das Ergebnis dieser Prozesse. Eine der wichtigsten Größen hierbei ist die Temperatur. Erhöhte Temperaturen können die Aktivierungsenergie verringern und damit die Reaktionsgeschwindigkeit erhöhen.
Ein weiterer signifikanter Einflussfaktor ist der Druck, insbesondere bei Gasreaktionen. Höherer Druck kann zu einer höheren Reaktionsrate führen, da die Anzahl der teilnehmenden Moleküle pro Volumeneinheit erhöht wird.
Auch die Konzentrationen der Ausgangsstoffe sind wichtige Parameter. Bei ausreichender Konzentration finden mehr Kollisionen zwischen den Molekülen statt, was die Wahrscheinlichkeit erhöht, dass die Reaktion stattfindet. Dies hat unmittelbare Auswirkungen auf die Stöchiometrie und kann helfen, das gewünschte Produkt in optimalen Mengen zu erzeugen.
Der Einsatz von Katalysatoren sollte ebenfalls nicht außer Acht gelassen werden. Katalysatoren steuern chemische Reaktionen, indem sie alternative Reaktionsmechanismen bieten oder Zwischenschritte entstehen lassen, wodurch sich die Aktivierungsenergie weiter verringert und die Reaktionsgeschwindigkeit erhöht wird.
Zusätzlich spielt die Anwesenheit von Lösungsmitteln oft eine bedeutende Rolle. Diese können nicht nur die Reaktanten in Kontakt bringen, sondern auch spezifische Wechselwirkungen mit diesen eingehen, welche die Reaktion begünstigen.
Schließlich können Licht und pH-Wert ebenfalls signifikant sein. Einige Reaktionen benötigen Licht (Photoreaktionen), um aktiviert zu werden. Andere erfordern spezifische pH-Bedingungen, da der Säure-Base-Haushalt das Reaktionsgleichgewicht erreichen lässt.
Anwendung in Alltag und Industrie
Chemische Reaktionen spielen sowohl im Alltag als auch in der Industrie eine zentrale Rolle. Ein alltägliches Beispiel ist das Kochen. Beim Erhitzen von Lebensmitteln laufen komplexe chemische Reaktionen ab, die ihre Struktur und ihren Geschmack verändern. Etwa die Maillard-Reaktion, welche für die Bräunung und den typischen Geschmack von gegrilltem Fleisch verantwortlich ist.
Auch bei der Reinigung kommen chemische Reaktionen zum Einsatz. Waschmittel enthalten Enzyme, die Proteine, Fette und Kohlenhydrate aufspalten. Zudem erfährt man chemische Prozesse während des Atems: Sauerstoff wird eingeatmet und in den Zellen in einem Vorgang verbrannt, der Energie freisetzt – molekulare chemische Prozesse sind hierbei unverzichtbar.
In der Industrie sind chemische Reaktionen allgegenwärtig. Die Herstellung von Düngemitteln etwa basiert auf dem Haber-Bosch-Verfahren, bei dem Stickstoff und Wasserstoff zu Ammoniak reagieren. Dieses Verfahren dient dazu, die Agrarerträge weltweit erheblich zu steigern.
Auch die Pharmaindustrie nutzt chemische Reaktionen, um Medikamente herzustellen. Hierbei geht es darum, aktive Wirkstoffe zu synthetisieren und deren Wirksamkeit zu maximieren. Durch das Zwischenschritte analysieren kann die Effizienz solcher Prozesse kontinuierlich verbessert werden.
Im Energiesektor hat sich die Verbrennung von fossilen Brennstoffen wie Kohle und Erdöl als eine der zentralsten technologischen Anwendungen von Chemie etabliert. Schließlich sind Batterien und Akkus Beispiele für elektrochemische Reaktionssysteme, die aus unserem Lebensalltag kaum wegzudenken sind.
Video: Einfache chemische Reaktionen
Video-Link: https://www.youtube.com/watch?v=66T22cSw-34
Sicherheitsmaßnahmen bei chemischen Reaktionen
Um sicherzustellen, dass chemische Reaktionen sicher durchgeführt werden können, gibt es einige wichtige Maßnahmen, die beachtet werden sollten. Zunächst muss immer eine Gefährdungsbeurteilung durchgeführt werden. Diese umfasst die Identifizierung der Gefahrenstoffe sowie das Verständnis ihrer potenziellen Risiken. Jede Gefahr sollte klar dokumentiert sein und geeignete Schutzmaßnahmen müssen entwickelt werden.
Schutzkleidung ist ein weiterer wesentlicher Aspekt. Tragen Sie stets geeignete Schutzausrüstung wie Laborkittel, Schutzbrillen und Handschuhe. Dies schützt nicht nur vor chemischen Spritzern, sondern auch vor möglichen Verbrennungen und anderen Verletzungen.
Die richtige Belüftung ist entscheidend, insbesondere wenn flüchtige oder toxische Substanzen verwendet werden. Ein Abzug kann helfen, schädliche Dämpfe aufzufangen und abzuführen. Sorgen Sie dafür, dass alle Ventilationssysteme ordnungsgemäß funktionieren und regelmäßig gewartet werden.
Vermeiden Sie jeglichen direkten Kontakt mit Chemikalien und halten Sie sich an die Sicherheitsdatenblätter (SDB) für Informationen über die Handhabung und Lagerung von Stoffen. Sicherheitsdatenblätter bieten wichtige Informationen zur sicheren Verwendung und sollen jederzeit zugänglich sein.
Notfallausrüstung wie Feuerlöscher, Augenspülstationen und Erste-Hilfe-Kästen sollten in unmittelbarer Nähe zum Labor verfügbar sein. Machen Sie sich regelmäßig mit den Standorten dieser Ausrüstungen vertraut und üben Sie Notfallsituationen, damit im Ernstfall schnell reagiert werden kann.
Zum Schluss: Arbeiten Sie nie allein im Labor. Es ist wichtig, dass immer jemand in der Nähe ist, um im Fall eines Unfalls sofort Hilfe leisten zu können.