Reaktionstyp in der Chemie
Chemische Reaktionen sind fundamentale Prozesse, die unser tägliches Leben beeinflussen. Sie treten in verschieden Formen auf und können diverse Resultate erbringen. Diese Reaktionen werden üblicherweise in spezifische Typen eingeteilt, basierend auf den Mechanismen und Produkten der jeweiligen Umwandlungen.
Einige dieser Typen umfassen exotherme und endotherme Reaktionen, bei denen Energie entweder freigesetzt oder aufgenommen wird, sowie Redoxreaktionen, wo Elektronentransfer eine zentrale Rolle spielt. Bei Säure-Base-Reaktionen werden Protonen zwischen den beteiligten Molekülen ausgetauscht, was zu signifikanten Änderungen der Zusammensetzungen führt.
Weitere verbreitete Reaktionstypen beinhalten Substitution, Addition und Eliminierung, welche durch das Ersetzen, Verbinden oder Abspalten von Atomen oder Molekülgruppen gekennzeichnet sind. Das Verständnis dieser Prozesse ist entscheidend, um Einblicke in die Thermodynamischen Faktoren, Chemischen Kräfte und die Strukturreaktivität zu gewinnen, die chemische Reaktionen antreiben.
Das Wichtigste in Kürze
- Exotherme Reaktionen setzen Energie frei, endotherme nehmen Energie auf.
- Redoxreaktionen umfassen Übertragung von Elektronen zwischen Molekülen.
- Säure-Base-Reaktionen beinhalten Protonenübertragungen zwischen Teilchen.
- Substitution ersetzt ein Atom oder Molekül durch ein anderes.
- Eliminierung spaltet Atome oder Molekülgruppen vom Ausgangsmolekül ab.
Es gibt verschiedene Reaktionstypen bei chemischen Reaktionen, darunter die Synthese, bei der aus zwei oder mehr Ausgangsstoffen ein neuer Stoff gebildet wird. Die Zersetzung ist ein weiterer Reaktionstyp, bei dem ein Stoff in einfachere Substanzen zerlegt wird. Außerdem gibt es die Neutralisationsreaktion, bei der eine Säure und eine Base miteinander reagieren und Salz sowie Wasser gebildet werden.
Neben den genannten Reaktionstypen gibt es noch weitere, wie beispielsweise die Redoxreaktion, bei der Elektronen zwischen den Reaktionspartnern ausgetauscht werden. Auch die Esterbildung, die Veresterung und die Substitutionsreaktion sind weitere Beispiele für verschiedene Reaktionstypen in der Chemie. Jeder Reaktionstyp hat spezifische Merkmale und Abläufe, die charakteristisch für ihn sind.
Exotherme und endotherme Reaktionen sind ebenfalls wichtige Reaktionstypen in der Chemie. Exotherme Reaktionen geben Wärme an die Umgebung ab, während endotherme Reaktionen Wärme aus der Umgebung aufnehmen. Diese Reaktionstypen basieren auf dem Energieumsatz während einer chemischen Reaktion und spielen eine bedeutende Rolle in vielen chemischen Prozessen.
Substitution, Addition und Eliminierung sind weitere wichtige Reaktionstypen in der organischen Chemie. Bei der Substitutionsreaktion wird ein Atom oder eine funktionelle Gruppe durch eine andere ersetzt. Die Addition beinhaltet das Hinzufügen eines Moleküls zu einer Doppel- oder Dreifachbindung. Die Eliminierungsreaktion hingegen führt zur Entfernung von Atomen oder Gruppen aus einem Molekül und zur Bildung einer Doppelbindung. Jeder dieser Reaktionstypen hat spezifische Charakteristika und Anwendungen in der organischen Chemie.
| Reaktionstyp | Erklärung |
|---|---|
| Synthese | Bei der Synthese werden aus zwei oder mehr Ausgangsstoffen ein neuer Stoff gebildet. |
| Zersetzung | In einer Zersetzungsreaktion wird ein Stoff in einfachere Substanzen zerlegt. |
| Neutralisation | Bei der Neutralisationsreaktion reagieren eine Säure und eine Base miteinander, wobei Salz und Wasser gebildet werden. |
| Redoxreaktion | In einer Redoxreaktion erfolgt ein Elektronenaustausch zwischen den Reaktionspartnern. |
| Esterbildung | Die Esterbildung ist eine Reaktion, bei der ein Ester aus einer Säure und einem Alkohol gebildet wird. |
| Veresterung | Veresterung ist die chemische Reaktion, bei der aus einer Säure und einem Alkohol ein Ester entsteht. |
| Substitutionsreaktion | Bei der Substitutionsreaktion wird ein Atom oder eine funktionelle Gruppe durch eine andere ersetzt. |
| Additionsreaktion | Die Additionsreaktion beinhaltet das Hinzufügen eines Moleküls zu einer Doppel- oder Dreifachbindung. |
| Eliminierungsreaktion | Die Eliminierungsreaktion führt zur Entfernung von Atomen oder Gruppen aus einem Molekül und zur Bildung einer Doppelbindung. |
| Exotherme Reaktion | Exotherme Reaktionen geben Wärme an die Umgebung ab und führen zu einer Erwärmung. |
| Endotherme Reaktion | Endotherme Reaktionen nehmen Wärme aus der Umgebung auf und führen zu einer Abkühlung. |
Exotherme und endotherme Reaktionen: Energieabgabe oder -aufnahme
Exotherme und endotherme chemische Reaktionen sind fundamentale Prozesse, die durch den Energieaustausch gekennzeichnet sind. Bei exothermen Reaktionen wird Energie in Form von Wärme freigesetzt. Ein klassisches Beispiel sind Verbrennungsprozesse, bei denen Brennstoffe wie Holz oder Kohle mit Sauerstoff reagieren, um Kohlendioxid und Wasser zu bilden. Diese Freisetzung von Wärme macht exotherme Reaktionen besonders thermodynamisch günstig; sie verlaufen oft spontan.
Auf der anderen Seite stehen endotherme Reaktionen, bei denen Energie aus der Umgebung aufgenommen wird. Diese Energieaufnahme ist notwendig, um die chemischen Bindungskräfte innerhalb der Moleküle aufzubrechen und neue Verbindungen zu schaffen. Ein anschauliches Beispiel ist die Photosynthese: Pflanzen nutzen Lichtenergie, um Wasser und Kohlendioxid in Glukose und Sauerstoff umzuwandeln.
Die Strukturreaktivität spielt eine entscheidende Rolle in beiden Reaktionstypen. Während exotherme Reaktionen häufig durch eine Abnahme der Entropie begleitet werden, steigt die Entropie bei endothermen Reaktionen an, da Ordnung geschaffen wird. Katalysatoren können beide Reaktionstypen beschleunigen, indem sie die Aktivierungsenergie herabsetzen, ohne selbst verbraucht zu werden. Allerdings müssen Inhibitoren und Katalysatorgifte vermieden werden, da sie die Effektivität von Katalysatoren stark beeinträchtigen können.
Dieser Energieaustausch hat praktische Anwendungen, beispielsweise in Batterienreaktionen und Galvanischen Zellen, wo chemische Energie in elektrische Energie umgewandelt wird. Auch Elektrolyseprozesse profitieren von einem genauen Verständnis dieser Prinzipien. Somit eröffnet das Wissen über exotherme und endotherme Reaktionen ein breites Spektrum an technologischen Nutzungsmöglichkeiten.
Chemische Reaktionen sind die Maschinen, die unsere Welt antreiben und formen. – Marie Curie
| Reaktionstyp | Beispiel |
|---|---|
| Exotherme Reaktion | Verbrennung von Holz |
| Endotherme Reaktion | Photosynthese |
| Redoxreaktion | Rosten von Eisen |
| Säure-Base-Reaktion | Neutralisation von Salzsäure mit Natronlauge |
| Substitution | Chlorierung von Methan |
| Addition | Hydrierung von Ethylen |
| Eliminierung | Dehydratisierung von Alkohol |
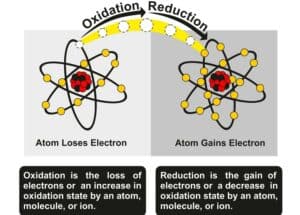
Redoxreaktionen: Elektronenakkzeptoren und -donatoren
Redoxreaktionen sind ein grundlegendes Konzept in der Chemie und beinhalten die Übertragung von Elektronen zwischen Atomen oder Molekülen. Diese Reaktionen bestehen aus zwei parallelen Prozessen: Oxidation und Reduktion.
Bei der Oxidation gibt ein Atom oder Molekül Elektronen ab, während bei der Reduktion ein Atom oder Molekül Elektronen aufnimmt. Die Substanz, die Elektronen abgibt, bezeichnet man als Elektronendonator, während diejenige, die Elektronen aufnimmt, als Elektronenakzeptor bekannt ist. Ein Beispiel hierfür findet sich bei den chemischen Prozessen in Batterien und Galvanischen Zellen.
Dieses Wechselspiel von Elektronenübertragungen beeinflusst stark die Strukturreaktivität und kann durch verschiedene Faktoren wie Thermodynamische Kräfte und Entropieänderungen gesteuert werden. In der Praxis finden solche Reaktionen nicht nur in elektrochemischen Zellen statt, sondern auch bei vielen biologischen Prozessen und industriellen Anwendungen.
Ein wichtiges Anwendungsbeispiel ist die Elektrolyse, bei der durch Anlegen einer elektrischen Spannung Stoffe zerlegt werden. Während dieses Prozesses können bestimmte Substanzen als Katalysatoren wirken, um die Reaktionsgeschwindigkeit zu erhöhen. Es ist jedoch auch möglich, dass sogenannte Katalysatorgifte oder Inhibitoren die Effizienz der Reaktion vermindern.
Die Untersuchung der Energieprofile von Reaktionen ist entscheidend, um besser zu verstehen, wie und warum Redoxreaktionen ablaufen. Solche Einsichten sind nützlich für die Entwicklung effizienter Systeme zur Energiegewinnung und -speicherung, wie sie bei Batterienreaktionen wichtig sind.
| Reaktionstyp | Beschreibung | Anwendungsbeispiel |
|---|---|---|
| Exotherme Reaktion | Freisetzung von Energie in Form von Wärme | Verbrennung von Kohle |
| Endotherme Reaktion | Aufnahme von Energie aus der Umgebung | Elektrolyse von Wasser |
| Redoxreaktion | Übertragung von Elektronen zwischen Atomen oder Molekülen | Galvanische Zellen |
Säure-Base-Reaktionen: Protonenübertragungen zwischen Reaktionsteilnehmern
Säure-Base-Reaktionen spielen eine zentrale Rolle in der Chemie und sind durch den Austausch von Protonen gekennzeichnet. Bei diesen Reaktionen handelt es sich im Wesentlichen um die Übertragung eines Protons (H⁺) von einer Säure zu einer Base. Dabei gibt die Säure das Proton ab, während die Base es aufnimmt.
Ein klassisches Beispiel für eine Säure ist Salzsäure (HCl), die im Wasser ein Proton abgibt und Chlorid-Ionen (Cl⁻) zurücklässt. Die entstehende Base könnte hier zum Beispiel das Hydroxid-Ion (OH⁻) sein, welches das Proton aufnimmt und dadurch zu Wasser (H₂O) wird. Solche Reaktionen sind immens wichtig für eine Vielzahl von Prozessen, einschließlich biologischer Systeme und industrieller Anwendungen.
Die thermodynamischen Eigenschaften solcher Reaktionen hängen stark von der beteiligten Säure oder Base sowie dem Medium ab, in dem die Reaktion stattfindet. Bei der Betrachtung dieser Wechselwirkungen spielen auch die chemischen Kräfte zwischen den Teilchen eine große Rolle. Hierbei ist vor allem die Strukturreaktivität entscheidend: Wie leicht gibt eine Säure ihr Proton ab? Wie effizient kann eine Base dieses aufnehmen?
Darüber hinaus beeinflusst die sogenannte Entropieänderung das Gleichgewicht der Reaktion. Dies beschreibt im Allgemeinen die geordnete oder ungeordnete Verteilung der Energie innerhalb des Systems.
Typische Beispiele aus dem Alltag finden sich in Batterienreaktionen und galvanischen Zellen, wo Elektrolyseprozesse benutzt werden, um elektrische Energie durch chemische Reaktionen zu erzeugen. In solchen Systemen können Katalysatorgifte und Inhibitoren durch Beeinflussung der Säure-Base-Gleichgewichte die Effizienz der Reaktionen stark verändern.
Substitution: Ersetzen eines Atoms oder Moleküls
Bei der Substitution handelt es sich um eine chemische Reaktion, bei der ein Atom oder eine Molekülgruppe durch ein anderes Atom oder eine andere Gruppe ersetzt wird. Dies ist besonders wichtig in der organischen Chemie und spielt eine zentrale Rolle bei der Synthese komplexer Moleküle.
Ein klassisches Beispiel für eine Substitutionsreaktion ist die nukleophile Substitution, bei der eine nukleophile Spezies (beispielsweise ein Hydroxid-Ion) ein anderes Atom oder eine Gruppe im Molekül ersetzt. Diese Art von Reaktionen kann verschiedene Mechanismen umfassen, wie die SN1- oder SN2-Reaktionsmechanismen.
Katalysatorgifte und Inhibitoren sind wichtige Aspekte, die auf Substitutionsreaktionen Einfluss nehmen können. Sie verändern entweder den Verlauf der Reaktion oder blockieren bestimmte Aktionspunkte innerhalb des Katalysators, was schlussendlich zu einer Reduktion der Reaktionsgeschwindigkeit führen kann.
Die Strukturreaktivität eines Moleküls spielt dabei eine entscheidende Rolle. Bestimmte chemische Kräfte wie intermolekulare Wechselwirkungen und thermodynamische Faktoren müssen ebenfalls beachtet werden, da sie die Energieprofile von Reaktionen beeinflussen.
Solche Reaktionen finden vielfach Anwendung, etwa beim Funktionalisieren von Molekülen in synthetischer Chemie oder beim Einsatz in Batterienreaktionen und Galvanischen Zellen. Auch bei Elektrolyseprozessen treten oft Substitutionsreaktionen auf, die essenziell für die elektrochemische Änderung von Stoffen sind.
Zusammengefasst lässt sich sagen, dass Substitutionsreaktionen wegen ihrer Vielseitigkeit und Breite einen wichtigen Platz in der gesamten Chemie haben und oft auch als Zwischenstufe anderer Reaktionen unter stark variierenden Bedingungen auftreten können.
Woran erkenne ich eine chemische Reaktion? – Merkmale einer chemischen Reaktion
Video-Link: https://www.youtube.com/watch?v=mUJyHHAo9pY
Addition: Verbindung zweier Atome oder Moleküle
Die Addition ist ein Reaktionstyp, bei dem sich zwei Atome oder Moleküle zu einem größeren Gebilde verbinden. Dies geschieht durch das Aufbrechen von Doppel- oder Dreifachbindungen in organischen Verbindungen, wodurch Platz für neue Bindungen entsteht.
Ein klassisches Beispiel für eine Additionsreaktion ist die Verbindung eines Alkens mit einem anderen reaktionsfreudigen Molekül. Diese Art der Reaktion ist besonders relevant in der Chemie von ungesättigten Kohlenwasserstoffen und hat industrielle Anwendungen bei der Herstellung von Kunststoffen und synthetischen Materialen.
Thermodynamische Aspekte spielen hierbei eine wesentliche Rolle. Die Reaktion wird nur dann ablaufen, wenn sie energetisch begünstigt ist, also wenn die entstehenden Produkte energieärmer sind als die Ausgangsstoffe.
Ein zentraler Begriff in dieser Diskussion ist die Entropieänderung. Bei einer Addition nimmt die Entropie oft ab, was thermodynamische Konsequenzen haben kann. Dies ist ein wichtiger Punkt in der Chemischen Kräfte, die diese Reaktionen antreiben.
Zusätzlich können Katalysatoren, sogenannte Inhibitoren, hinzugefügt werden, um die Reaktionsgeschwindigkeit zu beeinflussen oder unerwünschte Nebenreaktionen zu verhindern. Sie ändern jedoch nicht das Gleichgewicht der Reaktion selbst, sondern nur den Weg dorthin.
Solche Additionsreaktionen finden auch Bedeutung in elektrochemischen Prozessen wie Batterienreaktionen und Galvanische Zellen, wobei das Hinzufügen von Molekülen an Elektrodenoberflächen chemische Energie in elektrische Energie umwandeln kann.
Eliminierung: Abspaltung von Atomen oder Molekülgruppen
Eliminierungsreaktionen gehören zu den grundlegenden Reaktionen in der organischen Chemie. Dabei werden Atome oder Molekülgruppen von einem Molekül abgespalten, um eine neue Struktur zu erzeugen. Ein klassisches Beispiel dafür ist die Bildung von Alkenen aus Alkoholen durch Dehydrierung.
Die Eliminierung kann durch den Einsatz spezieller Katalysatoren oder unter extremeren Bedingungen wie hoher Temperatur und Druck unterstützt werden. Hierbei spielen thermodynamische Faktoren eine wichtige Rolle, da sie bestimmen, ob die Abspaltung energetisch begünstigt ist.
Ein bekanntes Experiment zeigt die Umwandlung von Ethanol zu Ethylen mittels Schwefelsäure als Katalysator. Die Schwefelsäure hilft dabei, das Wasserstoffatom und die Hydroxylgruppe von Ethanol zu entfernen, was zur Entstehung von Ethylen führt. Diese Reaktion wird oft in Labor- und Industrieprozessen genutzt.
Strukturreaktivität und chemische Kräfte entscheiden darüber, welche Bindungen im Molekül am ehesten gebrochen werden. Auch Energieprofile von Reaktionen sind entscheidend für das Verständnis dieser Prozesse. Durch die Erstellung solcher Profile können Wissenschaftler besser voraussagen, welche Produkte bei welchen Bedingungen entstehen.
In technisch anspruchsvolleren Anwendungen, wie beispielsweise der Herstellung von Pharmazeutika, müssen Inhibitoren vermieden werden, die verhindern könnten, dass die gewünschte Eliminierung abläuft. Ebenso können Katalysatorgifte problematisch sein, weil sie die aktiven Zentren des Katalysators blockieren können.
Zusammengefasst stellt die Eliminierungsreaktion ein mächtiges Werkzeug dar, das tiefgreifende Einblicke in die chemischen Eigenschaften von Verbindungen erlaubt und vielfältige industrielle Anwendungen ermöglicht.