Was sind Reinstoffe Beispiele?
Beispiele für Reinstoffe in der Chemie: In der Wissenschaft sind Reinstoffe von großer Bedeutung, da sie oft als Grundbausteine für zahlreiche chemische Prozesse dienen. Ein typisches Beispiel ist Wasser (H2O), das als lebensnotwendiges Molekül in allen Lebensformen vorhanden ist. Sauerstoff (O2) spielt eine entscheidende Rolle bei der Atmung und in verschiedenen Oxidationsprozessen.
Ein anderes bekanntes Beispiel ist Kohlenstoffdioxid (CO2), welches für die Photosynthese in Pflanzen unentbehrlich ist und gleichzeitig ein Indikator für den Klimawandel darstellt. Reines Gold (Au) wird häufig in Schmuck und Elektronik verwendet und zeichnet sich durch seine chemische Inertheit aus. Auch Natriumchlorid (NaCl), besser bekannt als Speisesalz, hat vielfältige Anwendungen, darunter Elektrolytausgleich und Konservierung.
Das Wichtigste in Kürze
- Wasser (H2O) ist lebensnotwendig und für viele biologische und industrielle Prozesse unentbehrlich.
- Sauerstoff (O2) spielt eine zentrale Rolle bei der Atmung und Oxidationsprozessen.
- Kohlenstoffdioxid (CO2) ist entscheidend für die Photosynthese und ein Indikator für den Klimawandel.
- Reines Gold (Au) ist chemisch inert, wird in Schmuck und Elektronik verwendet.
- Natriumchlorid (NaCl) bekannt als Speisesalz, dient als Elektrolyt und Konservierungsmittel.
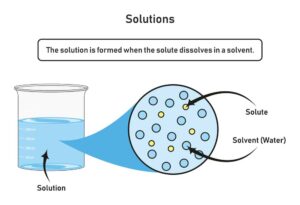
Einige Beispiele für Reinstoffe in der Chemie sind Elemente wie Gold, Silber und Sauerstoff. Des Weiteren zählen Verbindungen wie Wasser (H2O), Kochsalz (NaCl) und Schwefelsäure (H2SO4) zu den Reinstoffen. Diese Substanzen bestehen jeweils aus nur einer Art von chemischem Element oder Verbindung und können nicht weiter unterteilt werden.
Wasser: H2O, lebensnotwendiges Molekül, in allen Lebensformen
Wasser (H2O) ist ein Molekül, das aus zwei Wasserstoffatomen und einem Sauerstoffatom besteht. Es ist allgegenwärtig auf unserem Planeten und spielt eine entscheidende Rolle in verschiedenen Prozessen.
Inzwischen wissen wir, dass jede Lebensform auf Wasser angewiesen ist. Es wirkt nicht nur als Lösungsmittel, sondern ist auch an chemischen Reaktionen beteiligt, die für das Leben unerlässlich sind. Rund 70 % der Erdoberfläche sind mit Wasser bedeckt, was seine immense Bedeutung unterstreicht.
Wasser ist außerdem bekannt für seine einzigartige Fähigkeit, Wärme zu speichern. Dies trägt zur Stabilisierung des Klimas bei und ermöglicht es Lebewesen, in verschiedenen Umgebungen zu überleben. Die besonderen Eigenschaften von Wasser wie Oberflächenspannung, Dichteanomalie und sein Verhalten als Lösungsmittel machen es zu einem unverzichtbaren Bestandteil sowohl in biologischen Systemen als auch in industriellen Anwendungen.
Zusätzlich spielt Wasser eine Schlüsselrolle im Stoffwechsel aller lebenden Organismen. Es transportiert Nährstoffe, entfernt Abfallprodukte und reguliert die Temperatur. Ohne Wasser wäre es unmöglich, viele der Prozesse aufrechtzuerhalten, die für das Leben notwendig sind.
Wir vergessen, dass der Wasserzyklus und der Lebenszyklus eins sind. – Jacques Cousteau
| Reinstoff | Besondere Eigenschaft |
|---|---|
| Wasser (H2O) | Lebensnotwendiges Molekül |
| Sauerstoff (O2) | Wichtig für Atmung |
| Kohlenstoffdioxid (CO2) | Unentbehrlich für Photosynthese |
| Reines Gold (Au) | Chemisch inert |
| Natriumchlorid (NaCl) | Vielfältige Anwendungen, z.B. als Speisesalz |
| Diamant | Härtestes natürliches Material |
| Reinstes Silizium | Halbleiterherstellung |
| Stickstoff (N2) | Großer Anteil in der Atmosphäre |
Sauerstoff: O2, wichtig für Atmung, Oxidationsprozesse
Sauerstoff (O2) ist ein lebensnotwendiges, farbloses und geruchloses Gas, das einen bedeutenden Anteil an der Luft ausmacht. Es besteht aus zwei Sauerstoffatomen, die eine kovalente Doppelbindung eingehen. Sauerstoff spielt eine entscheidende Rolle für die Atmung aller aeroben Lebewesen.
Während des Prozesses der Zellatmung wird O2 verwendet, um Nährstoffe, insbesondere Glukose, in Energie umzuwandeln. Diese Energie ist notwendig für zahlreiche lebenswichtige Funktionen im Körper. Ohne ausreichenden Sauerstoff würden diese Prozesse nicht stattfinden können, was zu lebensbedrohlichen Zuständen führen kann.
Ein weiteres wichtiges Merkmal von Sauerstoff ist seine Fähigkeit zur Oxidation. Dieser Prozess ist grundlegender Bestandteil vieler chemischer Reaktionen und industrieller Verfahren. Beispielsweise wird in Hochöfen mit Hilfe von Sauerstoff Eisen aus Erz gewonnen.
In der Umwelt hat O2 ebenfalls wichtige Aufgaben. Pflanzen produzieren während der Photosynthese Sauerstoff als Nebenprodukt, indem sie Kohlendioxid und Wasser unter dem Einfluss von Sonnenlicht in organische Verbindungen umwandeln. Diese Sauerstoffproduktion ist essenziell für das Fortbestehen des Lebens auf unserem Planeten.
Zusammengefasst lässt sich sagen, dass die Anwesenheit und Funktion von Sauerstoff sowohl in biologischen als auch in chemischen Prozessen unverzichtbar ist. Von der Förderung der Atmung bis hin zu seiner Beteiligung an verschiedenen industriellen Anwendungen zeigt Sauerstoff seine umfassende Bedeutung.
Kohlenstoffdioxid: CO2, Pflanzenphotosynthese, Klimawandelindikator
Kohlenstoffdioxid, dessen chemische Formel CO2 lautet, spielt eine zentrale Rolle in der Pflanzenphotosynthese. Durch diesen Prozess nehmen Pflanzen CO2 aus der Atmosphäre auf und verwandeln es unter Einfluss von Sonnenlicht in Zucker und Sauerstoff. Dieser biologische Vorgang ist entscheidend für das Wachstum von Pflanzen und somit für die ganze Nahrungskette.
Ein weiterer wichtiger Aspekt von Kohlenstoffdioxid ist seine Funktion als Klimawandelindikator. CO2 gehört zu den Treibhausgasen, die die Erdoberfläche erwärmen, indem sie Infrarotstrahlung absorbieren und wieder abgeben. Seit der industriellen Revolution hat der Mensch durch Verbrennung fossiler Brennstoffe wie Kohle, Öl und Gas enorme Mengen an CO2 freigesetzt, was zur globalen Erwärmung beiträgt.
Das Monitoring des Kohlenstoffdioxidgehalts in der Atmosphäre erfolgt weltweit mittels verschiedener Messmethoden, darunter Satellitenbeobachtungen und Bodenstationen. Wissenschaftler nutzen diese Daten, um Modelle über zukünftige Klimaentwicklungen zu erstellen und potenzielle Umweltauswirkungen abzuschätzen.
Zusätzlich findet Kohlenstoffdioxid Anwendung in verschiedenen Industriebereichen. Es wird unter anderem in Feuerlöschern verwendet, da es Flammen ersticken kann. Auch in der Getränkeindustrie kommt CO2 zum Einsatz, zum Beispiel bei der Herstellung von kohlensäurehaltigen Getränken.
Zu guter Letzt sei erwähnt, dass Kohlenstoffdioxid in hoher Konzentration gesundheitsschädlich sein kann. Daher ist es wichtig, die Emissionen im Rahmen zu halten und nach nachhaltigen Lösungen zur Verringerung des CO2-Gehalts zu suchen.
Reines Gold: Au, Schmuck, Elektronik, chemisch inert
Reines Gold, auch als Au im Periodensystem bekannt, ist ein faszinierender Reinstoff. Seine chemischen und physikalischen Eigenschaften machen es zu einem der wertvollsten Metalle auf der Erde. Einer der bemerkenswertesten Aspekte von reinem Gold ist seine chemische Inertheit, was bedeutet, dass es nicht leicht mit anderen Elementen oder Verbindungen reagiert. Dies macht Gold besonders nützlich in verschiedenen Anwendungen, bei denen Langlebigkeit und Beständigkeit gefragt sind.
Ein bedeutender Einsatzbereich für reines Gold ist die Schmuckherstellung. Aufgrund seiner einzigartigen Farbe und seines Glanzes wird Gold seit Jahrtausenden für die Herstellung von hochwertigen Schmuckstücken verwendet. Der hohe Wert des Metalls trägt zudem zur Wahrnehmung von Luxus und Wohlstand bei, weshalb Goldschmuck oft als Investition betrachtet wird.
Darüber hinaus spielt Gold eine wichtige Rolle in der Elektronikindustrie. Dank seiner hervorragenden Leitfähigkeit und Korrosionsbeständigkeit wird es häufig in Verbindungselementen wie Steckern und Schaltern eingesetzt. Diese Eigenschaften sichern die Zuverlässigkeit und Haltbarkeit elektronischer Geräte, die in unserer modernen Gesellschaft allgegenwärtig sind.
Zusammengefasst zeigt sich, dass reines Gold durch seine einzigartigen Merkmale in zahlreichen Bereichen unverzichtbar ist. Von edlem Schmuck über kritische elektronische Anwendungen bis hin zu speziellen industriellen Prozessen findet dieses Metall vielseitige Einsatzmöglichkeiten.
Natriumchlorid: NaCl, Speisesalz, Elektrolytausgleich, Konservierung
Natriumchlorid ist den meisten als einfaches Speisesalz bekannt und besteht aus den chemischen Elementen Natrium (Na) und Chlor (Cl), was zu der Formel NaCl führt. Diese Verbindung spielt eine zentrale Rolle in vielen Aspekten unseres alltäglichen Lebens.
Im Bereich der Ernährung ist Speisesalz unverzichtbar, da es nicht nur den Geschmack vieler Lebensmittel verbessert, sondern auch als wichtiges Konservierungsmittel dient. Es hilft dabei, die Haltbarkeit von Nahrungsmitteln durch Hemmung des Bakterienwachstums zu verlängern.
Darüber hinaus ist Natriumchlorid ein entscheidender Faktor für den Elektrolytausgleich im menschlichen Körper. Elektrolyte sind notwendig, um elektrische Impulse zwischen Nervenzellen zu ermöglichen, welche grundlegend für Muskelkontraktionen und das Herzschlagrhythmus sind. Ein ausgewogenes Verhältnis dieser Mineralien trägt zu einer gesunden Funktion der Zellen und Organe bei.
In industriellen Anwendungen wird Natriumchlorid nicht nur in der Lebensmittelindustrie verwendet, sondern auch zur Herstellung zahlreicher anderer Produkte, einschließlich Seifen- und Waschmittelproduktion. Es dient ebenfalls als Rohstoff in chemischen Synthesen und spielt eine bedeutsame Rolle bei der Wasseraufbereitung.
Zusammenfassend lässt sich sagen, dass Natriumchlorid weit mehr bietet als nur geschmackliche Verbesserung – es ist essenziell für die körperliche Gesundheit und hat vielfältige industriellen Anwendungen.
| Reinstoff | Formel | Anwendung |
|---|---|---|
| Wasser | H2O | Lebensnotwendiges Lösungsmittel, Klimaregulierung |
| Sauerstoff | O2 | Atmung, Oxidationsprozesse |
| Kohlenstoffdioxid | CO2 | Photosynthese, Kohlensäurehaltige Getränke |
| Reines Gold | Au | Schmuck, Elektronik |
| Natriumchlorid | NaCl | Speisesalz, Elektrolyt |
| Diamant | C | Schneiden von Materialien, Schmuck |
| Reinstes Silizium | Si | Halbleiter, Photovoltaik |
| Stickstoff | N2 | Düngemittel, Kältemittel |
Diamant: Kohlenstoffstruktur, härtestes natürliches Material
Diamant ist eine spezielle Form von Kohlenstoff, in der die Atome in einer festen Kristallstruktur angeordnet sind. Diese Anordnung verleiht dem Diamanten seine außergewöhnlichen Eigenschaften.
Diamant gilt als das härteste bekannte natürliche Material, was ihn nicht nur für Schmuck, sondern auch für industrielle Anwendungen sehr wertvoll macht. Aufgrund seiner Härte und Langlebigkeit wird er in Schneidewerkzeugen und Bohrköpfen verwendet.
Ein bemerkenswertes Merkmal von Diamanten ist ihre Fähigkeit, Licht zu brechen und spektakulär zu reflektieren. Das macht sie besonders beliebt in hochwertigen Schmuckstücken wie Verlobungsringen und Halsketten.
Neben ihrer ästhetischen Bedeutung haben Diamanten auch zahlreiche wissenschaftliche Anwendungen. Zum Beispiel werden sie in Hochdruckforschungsexperimenten genutzt, um Druckverhältnisse zu simulieren, die tief im Erdinneren herrschen.
Die Tatsache, dass Diamanten aus reinem Kohlenstoff bestehen und zugleich über so besondere physikalische und chemische Eigenschaften verfügen, macht sie zu einem faszinierenden Beispiel für Reinstoffe in der Chemie.
Reinstes Silizium: Halbleiterherstellung, Computerchips, Photovoltaik
Reinstes Silizium ist von zentraler Bedeutung für viele moderne Technologien. Besonders in der Halbleiterherstellung wird es wegen seiner hervorragenden elektrischen Eigenschaften geschätzt.
In der Computerchip-Produktion spielt reines Silizium eine maßgebliche Rolle, da es die Grundlage für die Herstellung von Transistoren und anderen wichtigen Komponenten bildet. Transistoren sind wesentlicher Bestandteil von Elektronikgeräten, wodurch Silizium indirekt unseren Alltag stark beeinflusst.
Ein weiteres bedeutendes Anwendungsfeld für reines Silizium ist die Photovoltaik. Photovoltaikzellen, welche Sonnenlicht in elektrische Energie umwandeln, verwenden Silizium aufgrund seiner hohen Effizienz bei der Umwandlung des Lichtes. Dies macht Silizium zu einem Schlüsselelement im Bereich der erneuerbaren Energien.
Als chemisches Element hat Silizium zudem bemerkenswerte physikalische Eigenschaften, wie hohe Temperaturbeständigkeit und eine stabile Kristallstruktur. Diese Eigenschaften machen es nicht nur wichtig für die Halbleitertechnik, sondern auch für andere fortschrittliche technische Anwendungen.
Die Gewinnung und Reinigung von Silizium erfolgt meistens aus Quarzsand, wobei mehrere aufwendige Verfahren nötig sind, um den Reinheitsgrad zu erreichen, der für technologische Anwendungen erforderlich ist. Nur durch diese hohe Reinheit kann gewährleistet werden, dass das Silizium die geforderten Leistungsstandards erfüllt.
Stickstoff: N2, großer Anteil in der Atmosphäre
Ein bemerkenswertes Beispiel für Reinstoffe in der Chemie ist Stickstoff. Das chemische Symbol von Stickstoff lautet N2. Dieses farb- und geruchlose Gas stellt etwa 78% der Erdatmosphäre dar, was es zu einem der am häufigsten vorkommenden Elemente auf unserem Planeten macht.
Stickstoff spielt eine zentrale Rolle in verschiedenen biologischen und chemischen Prozessen. Zum Beispiel wird es in der Düngemittelindustrie verwendet, da Pflanzen Stickstoff benötigen, um Aminosäuren und Proteine zu synthetisieren. Darüber hinaus findet man Stickstoffverbindungen auch in vielen explosiven Substanzen wie Nitroglyzerin oder Ammoniumnitrat, die aufgrund ihrer hohen Stabilität wichtig für industrielle Anwendungen sind.
Die besondere Form des molekularen Stickstoffs mit einer doppelten Bindung zwischen den zwei Atomen verleiht ihm eine hohe chemische Stabilität. Diese starke Bindung bedeutet allerdings auch, dass molekularer Stickstoff relativ inert und selten direkt reaktiv ist. Durch verschiedene Fixierungsprozesse können bestimmte Mikroorganismen jedoch atmosphärischen Stickstoff in eine Form umwandeln, die von Pflanzen genutzt werden kann.
Ein weiteres Gebiet, in dem Stickstoff unverzichtbar ist, ist die Inertgas-Verwendung in industriellen Prozessen. Beispielsweise nutzt man Stickstoff, um feuergefährliche Atmosphären in bestimmten Produktionsumgebungen zu vermeiden. Auch in der Lebensmittelindustrie wird Stickstoff oft als Schutzatmosphäre eingesetzt, um Oxidation und somit das Verderben von Lebensmitteln zu verhindern.
Diese vielfältigen Nutzungsarten machen Stickstoff zu einem faszinierenden und wichtigen Bestandteil unseres täglichen Lebens sowie zu einem Schlüsselthema in der Chemie.