Entstehung von chemischen Salzen
Die Salz Entstehung ist ein faszinierender Prozess, bei dem chemische und physikalische Prinzipien eng miteinander verwoben sind. Ein zentrales Element hierbei ist die Bindung zwischen Natrium- und Chloridionen, die gemeinsam das bekannte Natriumchlorid (NaCl) bilden. Diese Ionenverbindung setzt eine starke elektrostatische Anziehungskraft frei, die zur Bildung eines stabilen Kristallgitters führt.
Salz entsteht in der Natur meist durch das Verdampfen von Meerwasser oder aus großen unterirdischen Lagerstätten. Beim Verdunsten des Wassers kristallisieren gelöste Ionen zu Ionenkristallen. Auch industrielle Verfahren wie die Elektrolyse können Salze erzeugen, indem sie gelöste Ionen in ihre einzelnen Elemente zerlegen und anschließend wieder zusammenführen. Die regelmäßige Ionenstruktur zeichnet sich entweder durch eine kubische oder orthorhombische Struktur aus und ist charakteristisch für die verschiedenen Erscheinungsformen des Salzes.
Das Wichtigste in Kürze
- Salz entsteht durch Verdampfen von Meerwasser und kristallisiert zu Natriumchlorid.
- Bergwerke fördern Steinsalz, welches aus festen Ionenkristallen besteht.
- Natrium- und Chloridionen bilden stabile Ionengitterstrukturen durch elektrostatische Anziehung.
- Elektrolyse spaltet Salzlösungen in ihre Elemente Chlor und Natrium.
- Natürliche Quellen wie Salzseen und Meere liefern große Mengen an Natriumchlorid.
Chemische Salze entstehen durch die Reaktion von Säuren mit Basen oder durch die Neutralisation von Säuren und Basen. Bei diesen Reaktionen tauschen die Ionen der Säure und der Base ihre Ladungen aus, wodurch das Salz gebildet wird. Die entstehenden Salze bestehen aus positiv geladenen Metallionen und negativ geladenen Nichtmetallionen, die sich zu einer stabilen Kristallstruktur anordnen.
In der Natur entstehen Salze durch verschiedene Prozesse wie die Verdunstung von Meerwasser in Salzseen, die Bildung von Salzablagerungen in Gesteinsschichten oder unterirdischen Salzlagerstätten. Diese natürlichen Salzvorkommen entstehen über lange Zeiträume durch geologische Prozesse, bei denen Salze aus dem Wasser ausfallen und sich ansammeln. Die natürlichen Salzlagerstätten werden durch tektonische Bewegungen und geologische Aktivitäten gebildet und können in verschiedenen Regionen der Welt gefunden werden.
Natrium- und Chloridionen verbinden sich
In der Chemie spielt die Entstehung von Salz eine zentrale Rolle. Ein häufiges Beispiel ist die Verbindung von Natriumionen (Na+) und Chloridionen (Cl–). Diese beiden Ionen binden sich aufgrund ihrer entgegengesetzten Ladungen.
Wenn ein Natriumatom ein Elektron abgibt, wird es zu einem positiv geladenen Kation. Gleichzeitig nimmt das Chloratom dieses Elektron auf und wird dadurch zu einem negativ geladenen Anion. Die starke elektrostatische Anziehungskraft zwischen diesen unterschiedlich geladenen Teilchen führt dazu, dass sie sich zu einer stabilen chemischen Verbindung zusammenfinden.
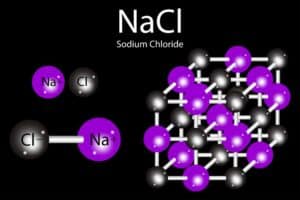
Diese Bindung erzeugt Ionenkristalle, bei denen die Ionen in einer regelmäßigen Anordnung auftreten. Dabei entsteht ein stabiles Kristallgitter, auch als Ionengitterstruktur bekannt. In solch einem Gitter befinden sich die Kationen und Anionen in einer kubischen Struktur, was bedeutet, dass sie in Form eines Würfels angeordnet sind. Es gibt jedoch auch andere Strukturen wie die orthorhombische Struktur.
Die Symmetrie und Stabilität dieser Strukturen werden durch die Absolute Gitterenergie beschrieben, die den energetischen Gewinn aus der Bildung des Gitters angibt. Je stärker die elektrostatische Anziehung zwischen Na+ und Cl– ist, desto höher ist die Stabilität des resultierenden Salzes und somit seine strukturelle Integrität.
Durch diese Prozesse erhält man das alltägliche Speisesalz, welches nicht nur in der Küche, sondern auch industriell weitreichende Anwendungen hat.
Das Leben wurde im Meer geboren. In den Tiefen des Urmeeres summten die Vorfahren allen Lebens um unvorstellbare Salzgehaltzusammenballungen. – Jacques Cousteau
| Strukturtyp | Beschreibung |
|---|---|
| Kubische Struktur | Die Ionen sind in Form eines Würfels angeordnet und bilden ein symmetrisches Gitter |
| Orthorhombische Struktur | Die Ionen sind in einem rechteckigen Gitter angeordnet und erzeugen ein weniger symmetrisches, aber stabiles Muster |
Ionische Bindung entsteht zwischen Na+ und Cl-
Eine wichtige chemische Reaktion, bei der Salz entsteht, ist die Bildung einer ionischen Bindung zwischen Natriumionen (Na+) und Chloridionen (Cl-). In diesem Prozess gibt das Natriumatom ein Elektron ab und wird somit zu einem positiv geladenen Ion oder Kation. Gleichzeitig nimmt das Chloratom ein Elektron auf und wird zu einem negativ geladenen Ion oder Anion.
Diese entgegengesetzt geladenen Ionen ziehen sich aufgrund der elektrostatischen Anziehung stark an. Es bildet sich eine stabile Verbindung, bekannt als Ionenkristall, in dem die Ionen in einer regelmäßigen Anordnung vorliegen. Diese Struktur nennt man auch ein Kristallgitter.
In diesem Gitter sind die Na+ und Cl- Ionen so angeordnet, dass sie eine höhere Stabilität erreichen. Diese geordnete Struktur kann verschiedene Formen annehmen, darunter die kubische und orthorhombische Struktur. Die Stärke dieser Bindung hängt von der sogenannten absoluten Gitterenergie ab, die die Energie beschreibt, die frei wird, wenn die Ionen zur Bildung des Gitters zusammenkommen.
Das Verständnis dieser Prozesse ermöglicht es uns, nicht nur zu verstehen, wie Salz entsteht, sondern auch, wie ähnliche ionische Verbindungen gebildet werden können.
Verdampfen von Meerwasser kristallisiert Salz
Das Verdampfen von Meerwasser ist eine der häufigsten Methoden zur Herstellung von Salz. Wenn man Meerwasser erhitzt, verdampft das Wasser, während die Salzbestandteile zurückbleiben und sich kristallisieren. Der Prozess beginnt mit dem Erhitzen des Meerwassers, sodass es zu einem gesättigten Zustand kommt und dann langsam verdampft.
Wenn das Wasser verdunstet, bleiben Natrium- und Chloridionen zurück, die sich verbinden und ein festes Kristallgitter bildet. In diesem Kristallgitter sind die positiven Natriumionen (Kationen) und die negativen Chloridionen (Anionen) durch elektrostatische Anziehungskräfte zusammengehalten. Dieses strukturierte Arrangieren von Ionen ist bekannt als Ionenkristalle.
Bei weiteren Verdampfungsprozessen kristallisiert das NaCl weiter aus und formt gut definierte Ionengitterstrukturen. Diese Strukturen können unterschiedliche Formen annehmen, am häufigsten jedoch eine kubische Struktur. Manchmal entsteht auch eine orthorhombische Struktur, je nachdem, wie die Ionen angeordnet sind und unter welchen Bedingungen sie kristallisieren.
Ein wichtiger Aspekt dieses Prozesses ist die Regelmäßige Anordnung der Ionen im Kristallgitter, was zu charakteristischen physikalischen Eigenschaften führt. Die resultierenden Kristalle besitzen eine hohe absolute Gitterenergie, was ihnen ihre Stabilität verleiht.
Bergwerke fördern Steinsalz aus der Erde
Der Bergbau ist ein entscheidender Prozess, um Steinsalz aus der Erde zu gewinnen. Eine Lagerstätte, die Salz in fester Form enthält, wird als Saline bezeichnet. Diese Vorkommen entstanden durch das Verdampfen von Meerwasser vor Millionen von Jahren und sind nun tief unter der Erdoberfläche begraben.
Steinsalz, auch bekannt als Halit, besteht hauptsächlich aus Natriumchlorid (NaCl) und bildet große Kristallgitter. Die Methode, mit der dieses Salz gewonnen wird, hängt oft vom spezifischen geologischen Umfeld ab. Ein gängiges Verfahren ist der unterirdische Abbau mit Sprengstoff, Bohrmaschinen oder sogar computergesteuerten Robotern.
Die Ionenkristalle im Steinsalz haben eine regelmäßige Struktur, die durch die elektrostatische Anziehung zwischen den Kationen (positiv geladenen Ionen) und Anionen (negativ geladenen Ionen) zusammengehalten wird. Dies führt zu einer stabilen Ionengitterstruktur, die entweder eine kubische oder orthorhombische Struktur sein kann, abhängig von den spezifischen Bedingungen der Kristallbildung.
Nach dem Abbauen muss das Rohsalz zerkleinert und gereinigt werden. In vielen Fällen wird es gewaschen, zentrifugiert und getrocknet, um Verunreinigungen zu entfernen und ein fertiges Produkt zu erzeugen. Schließlich wird das Salz für unterschiedliche Anwendungen, wie in der Nahrungsmittelindustrie oder bei der Herstellung von Chemikalien, verpackt und transportiert.
Das Verständnis der absoluten Gitterenergie ist ebenfalls wichtig, denn sie bestimmt, wie leicht das Salz kristallisieren kann oder welche besonderen Eigenschaften es besitzt. So zeigt sich, dass der Abbau von Steinsalz nicht nur technisch anspruchsvoll ist, sondern auch auf komplexer Chemie basiert.
Video: Salzablagerung: Entstehung der Salzvorkommen
Video-Link: https://www.youtube.com/watch?v=xgYWEt2kbPU
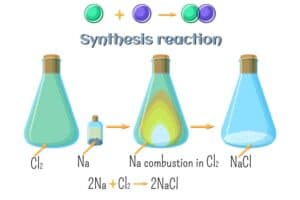
Elektrolyse spaltet Salzlösungen in Elemente
Die Elektrolyse bietet eine faszinierende Methode zur Gewinnung von Elementen aus Salzlösungen. Bei diesem Prozess wird elektrischer Strom verwendet, um chemische Verbindungen zu trennen. Wenn eine Salzlösung wie Natriumchlorid (NaCl) in Wasser gelöst und dann elektrolytisch gespalten wird, entstehen an der Anode Chlor (Cl₂) und an der Kathode Natrium (Na).
Diese Trennung basiert auf den Ladungen der Ionen: Na⁺-Kationen werden zur negativen Elektrode gezogen, während Cl⁻-Anionen zur positiven Elektrode wandern. Die elektrostatische Anziehung zwischen Kationen und Anionen ist dabei entscheidend.
Im Detail funktioniert die Elektrolyse folgendermaßen:
- Eine elektrische Spannung wird angelegt.
- Die positiven Na⁺-Ionen wandern zur Kathode (negative Elektrode).
- Gleichzeitig bewegen sich die negativen Cl⁻-Ionen zur Anode (positive Elektrode).
Die entstehenden Elemente können je nach Bedarf weiter verarbeitet oder direkt genutzt werden. Besonders wichtig ist dieser Prozess in der Industrie, etwa zur Herstellung von reinem Chlor oder Natrium.
Durch die gezielte Steuerung der Ströme und Spannungen kann man präzise kontrollieren, welche Produkte bei der Elektrolyse entstanden sollen. So stellt die Elektrolyse nicht nur eine effiziente Art der Stofftrennung dar, sondern ermöglicht auch die Erzeugung von reinen Metallen und Gasen.
| Prozess | Beschreibung | Beispiel |
|---|---|---|
| Ionische Bindung | Die elektrostatische Anziehung zwischen Kationen und Anionen | Natriumchlorid (NaCl) |
| Verdampfen von Meerwasser | Erhitzung des Wassers, um die Ionen zu kristallisieren | Speisesalzgewinnung |
| Elektrolyse | Trennung von Ionen durch elektrischen Strom | Gewinnung von Chlor und Natrium |
Ausfällung durch Verdünnung und Trocknung
Durch die Ausfällung und Trocknung kann Salz gewonnen werden. Dieser Prozess nutzt das Prinzip der Löslichkeit von Salzen in Wasser. Wenn eine gesättigte Salzlösung durch Verdünnen mit reinem Wasser behandelt wird, sinkt die Konzentration des gelösten Salzes unter das Niveau seiner Löslichkeit.
In dieser verdünnten Lösung beginnen die Natrium- (Na+) und Chloridionen (Cl-) zu reaggregieren, da ihre Bewegungsfreiheit eingeschränkt ist. Dies führt zur Bildung von festen Kristallen. Diese Kristallbildung hängt stark vom Konzentrationsgradienten und den Temperaturbedingungen ab. Die Geschwindigkeit der Kristallisation kann durch langsames Verdunsten des Wassers gesteuert werden.
Wenn das überschüssige Wasser schließlich vollständig entfernt ist, bleibt ein festes Netzwerk von Ionenkristallen zurück. In diesem Netzwerk sind die Kationen (Natriumionen) und Anionen (Chloridionen) in einer sogenannten Ionengitterstruktur regelmäßig angeordnet. Diese regelmäßige Anordnung resultiert aus der starken elektrostatischen Anziehung zwischen den entgegengesetzt geladenen Ionen.
Salzkristalle können unterschiedliche Strukturen annehmen, darunter die kubische Struktur und die orthorhombische Struktur. Diese verschiedenen Kristallgitter beeinflussen die physikalischen Eigenschaften des Salzes wie Härte und Löslichkeit weiter. Insgesamt ist die Ausfällung durch Verdünnung und Trocknung eine effiziente Methode zur Gewinnung von reinem Salz aus Lösungen, wobei das Endprodukt oft von hoher Reinheit und Qualität ist.
Verdampfungsprozesse hinterlassen Natriumchlorid
Verdampfungsprozesse sind entscheidend für die Gewinnung von Natriumchlorid aus natürlichen Ressourcen wie Meerwasser. Durch das Erhitzen oder durch natürliche solarbetriebene Verdampfung wird das Wasser in den Salzpfannen zum Verdampfen gebracht, während die im Wasser gelösten Salze zurückbleiben.
Wenn das Wasser verdunstet, beginnen sich die Natrium- und Chloridionen, die zuvor im Wasser gelöst waren, zu kristallisieren. Diese Ionen verbinden sich aufgrund der starken elektrostatischen Anziehungskraft zwischen den positiv geladenen Kationen (Na+) und den negativ geladenen Anionen (Cl-) und bilden ein stabiles Kristallgitter.
Die entstehende Struktur ist ein typisches Beispiel für einen Ionenkristall mit einer kubischen Struktur. In einigen Fällen kann auch eine orthorhombische Struktur beobachtet werden, abhängig von den spezifischen Umweltbedingungen und der Reinheit des Wassers.
Dieses Verfahren der Verdampfung ist besonders effizient in Regionen mit hohen Temperaturen und viel Sonnenschein, da die Solarenergie den Prozess der natürlichen Verdampfung beschleunigt. Nach Abschluss der Verdunstung bleibt das kristallisierte Natriumchlorid zurück und kann weiterverarbeitet oder direkt verwendet werden.
Denken Sie daran, dass wesentliche Aspekte solcher Verdampfungsprozesse die Konzentration und relative Verteilung der Ionen sowie die absolute Gitterenergie beeinflussen, welche die strukturelle Stabilität des gewonnenen Salzes bestimmt.
Natürliche Quellen wie Salzseen und Meere
Salzseen und Meere sind bedeutende natürliche Quellen für die Salzgewinnung. Hier existieren hohe Salzkonzentrationen, die durch verdunstendes Wasser zurückbleiben. Die Verdunstung des Wassers hinterlässt Natriumchlorid in Form von Kristallgittern. Diese Ionenkristalle bestehen aus strukturell angeordneten Kationen (positive Ionen) und Anionen (negative Ionen).
Die elektrostatische Anziehung zwischen den Natrium- und Chloridionen sorgt für eine stabile Ionengitterstruktur. Eine regelmäßige Anordnung der Ionen in kubischer oder orthorhombischer Struktur ist dabei charakteristisch.
Salzseen können, je nach ihrer chemischen Zusammensetzung und Herkunft, unterschiedliche Kristallformen bilden. Obwohl häufig ein Kubisches Gitter bei Natriumchlorid dominiert, kann unter anderen Bedingungen auch eine orthorhombische Struktur entstehen.
Bei natürlichen Salzquellen spielen Faktoren wie Temperatur und Konzentration des verbleibenden Wassers eine entscheidende Rolle. Zuletzt wird das entstandene Salz geerntet und weiterverarbeitet. In vielen Ländern sind solche natürlichen Salzquellen wirtschaftlich sehr wichtig und liefern beträchtliche Mengen Natriumchlorid zur Deckung des Bedarfs.
Da Meerwasser ebenfalls reich an verschiedenen Salzen ist, bietet es eine konstante und großflächig verfügbare Quelle. Ein einmaliger Aspekt bei der Gewinnung von Salz aus dem Meerwasser ist die allmähliche Erhöhung der Konzentration durch Verdunstung, bis schließlich festes Salz kristallisiert.