pH-Wert von Salzlösungen
Die Eigenschaft von Salzen beeinflusst den pH-Wert in verschiedenen Lösungen erheblich. Salzlösungen können in Abhängigkeit ihrer chemischen Zusammensetzung saure, neutrale oder basische pH-Werte aufweisen. Der pH-Wert wird oft anhand der Säure Basen Reaktion und Hydrolysevorgänge beurteilt.
Ein grundlegendes Verständnis der Neutralisation von Säuren durch Salze hilft, die Veränderungen im pH-Wert besser zu verstehen. Unterschiedliche Ionenkombinationen aus einer elektrolytischen Lösung können den pH-Wert signifikant verändern. Durch die pH-Wert Bestimmung lassen sich Rückschlüsse auf die Natur des Salzes ziehen.
Techniken wie die Elektrolyse von Salzen bieten Einblicke in das Verhalten von Salzlösungen. Das Messen des Säuregrads ermöglicht es, präzise Aussagen über die alkalische Reaktion bestimmter Lösungen zu treffen.
Das Wichtigste in Kürze
- Salze beeinflussen den pH-Wert durch die Freisetzung von H+ oder OH– in Wasser.
- Hydrolyse von Salzen kann saure oder basische Lösungen erzeugen.
- pH-Wert Bestimmung erfolgt durch pH-Meter oder Indikatoren.
- Säure-Basen-Reaktionen bei Salzen führen zu Neutralisationen und pH-Veränderungen.
- Salze wirken als Elektrolyte und leiten elektrischen Strom in Lösung.
Der pH-Wert von Salz liegt in der Regel bei 7, was neutral ist. Da Salze in Wasser dissoziieren, kann der pH-Wert jedoch je nach dem sauren oder basischen Charakter der entstehenden Lösung variieren. Es ist wichtig zu beachten, dass der pH-Wert von Salzlösungen durch die darin enthaltenen Ionen bestimmt wird.
Definition und Berechnung des pH-Werts
Der pH-Wert ist ein Maß für die Konzentration der Wasserstoffionen (H+) in einer Lösung und gibt deren Säuregrad an. Er wird auf einer Skala von 0 bis 14 gemessen, wobei niedrige Werte auf hohe Säure und hohe Werte auf Alkalität hinweisen. Ein Wert von 7 wird als neutral angesehen.
Zur Berechnung des pH-Werts verwendet man die Formel:
3O+]>. Diese Gleichung nutzt den negativen dekadischen Logarithmus der Konzentration der Hydronium-Ionen (H3O+). Zum Beispiel hätte eine Lösung mit einer H3O+-Konzentration von 1 × 10-7 mol/L einen pH-Wert von 7, was neutral ist.
In Bezug auf Salze hat jedes Salz seine eigene chemische Zusammensetzung, welche den pH-Wert beeinflussen kann. Wenn ein Salz in Wasser gelöst wird, kann es je nach seinen Bestandteilen eine alkalische oder saure Reaktion hervorrufen. Die Neutralisation von Säuren durch Basen und umgekehrt spielt hierbei eine wichtige Rolle. Dies führt oft zu signifikanten Veränderungen im pH-Wert der Lösung.
Es ist wichtig zu beachten, dass manche Salze bei der Elektrolyse von Salzen entstehen können, was ebenfalls den pH-Wert beeinflusst. Daher erfordert die präzise pH-Wert Bestimmung eine gründliche Kenntnis der beteiligten Ionen und ihrer Wechselwirkungen.
Die Untersuchung der Säure-Basen-Reaktionen und ihre Auswirkungen auf den pH-Wert sind von zentraler Bedeutung für das Verständnis chemischer Prozesse in Lösungen. – Justus von Liebig
| Salz | pH-Wert |
|---|---|
| Ammoniumchlorid (NH4Cl) | ca. 5 (sauer) |
| Natriumchlorid (NaCl) | 7 (neutral) |
| Natriumcarbonat (Na2CO3) | ca. 11 (basisch) |
| Kaliumhydroxid (KOH) | ca. 13 (sehr basisch) |
Eigenschaften und Verhalten von Salzen
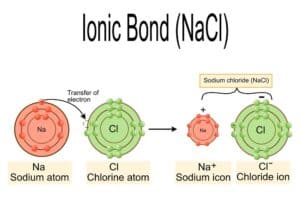
Salze sind chemische Verbindungen, die aus einem Kation (positiv geladenes Ion) und einem Anion (negativ geladenes Ion) bestehen. In vielen Fällen entstehen Salze durch Neutralisation von Säuren und Basen. Diese chemischen Reaktionen führen zur Bildung von Salzen und Wasser.
Ein wesentliches Merkmal der Eigenschaft von Salzen ist ihre Fähigkeit, in wässriger Lösung zu dissoziieren, das heißt, sie lösen sich in ihren Ionen auf. Dieser Prozess ist grundlegend für viele chemische und biologische Prozesse. Zum Beispiel wird Natriumchlorid (Kochsalz) in Wasser zu Natrium- und Chlorid-Ionen.
Auch die chemische Zusammensetzung von Salzen spielt eine entscheidende Rolle bei ihrem Verhalten. Unterschiedliche Kationen und Anionen bestimmen den Ausgangsstoff, aus dem das Salz gebildet wird, sowie dessen physikalische und chemische Eigenschaften.
Die Leitfähigkeit von Salzlösungen ist ein weiteres bedeutendes Merkmal. Da Salze als Elektrolyten fungieren, können sie im gelösten Zustand elektrischen Strom leiten. Dies ist besonders wichtig für Anwendungen wie die Elektrolyse von Salzen, wo elektrische Energie genutzt wird, um chemische Reaktionen zu erzwingen.
Zusammengefasst zeigen Salze vielfältige Eigenschaften und Verhaltensweisen, die auf ihrer Zusammensetzung und ihrer Reaktion mit Wasser basieren. Ihre Relevanz erstreckt sich über verschiedene Bereiche wie Chemie, Biologie und Industrie.
Salze in wässriger Lösung
In einer wässrigen Lösung zeigen Salze sehr spezifische Eigenschaften, die stark von ihrer chemischen Zusammensetzung abhängen. Wenn ein Salz in Wasser gelöst wird, zerfällt es in seine jeweiligen Ionen. Diese Prozesse sind entscheidend für das Verständnis des pH-Werts, da sie direkt den Säuregrad der Lösung beeinflussen können.
Einige Salze erzeugen eine saure oder basische Umgebung durch Hydrolyse. Bei der Hydrolyse reagieren die Ionen des Salzes mit dem Wasser, was zu einer Veränderung im pH-Wert führt. Zum Beispiel kann Ammoniumchlorid (NH4Cl) bei Auflösung eine leicht saure Lösung bilden, während Natriumkarbonat (Na2CO3) zu einer basischen Reaktion führt.
Die chemische Zusammensetzung und das Verhalten der Ionen in Lösung bestimmen letztlich, ob der pH-Wert säuerlich, neutral oder alkalisch ist. In der Chemie ist dies besonders wichtig, um die Neutralisation von Säuren durch Basen und umgekehrt zu verstehen. Es gibt eine Vielzahl an Beispielen, wo bestimmte Salze genutzt werden, um den pH-Wert in verschiedenen Anwendungen zu regulieren.
Weiterhin sollte man darauf achten, dass nicht alle Salze gleich reagieren. Einige Salze fungieren als Elektrolyte und beeinflussen dadurch stark die ionische Stärke der Lösung, was auch die elektrische Leitfähigkeit erhöht. Daher spielt die genaue Kenntnis über die spezifischen Eigenschaften jedes einzelnen Salzes eine wichtige Rolle bei der Vorhersage von pH-Veränderungen in wässrigen Lösungen.
pH-Werte von Salzlösungen
| Salzlösung | pH-Wert |
|---|---|
| Natriumchlorid | Neutral (7) |
| Kaliumchlorid | Neutral bis leicht sauer |
| Calciumchlorid | Leicht sauer bis neutral |
| Magnesiumchlorid | Neutral bis leicht basisch |
| Aluminiumchlorid | Leicht sauer |
| Eisen(III)-chlorid | Sauer |
| Zinkchlorid | Sauer bis neutral |
pH-Veränderungen durch Hydrolyse
Salze können durch Hydrolyse den pH-Wert ihrer Lösungen verändern. Die Hydrolyse ist ein chemischer Prozess, bei dem ein Ion aus einem Salz mit Wasser reagiert und dabei eine schwache Säure oder Base bildet. Dies führt häufig zu einer Veränderung des ursprünglichen Neutralpunktes der Lösung.
Ein klassisches Beispiel ist das Salz Natriumcarbonat (Na2CO3). In wässriger Lösung dissoziiert es in Natrium- (Na+) und Carbonat-Ionen (CO32-). Das Carbonat-Ion kann weiter hydrolysieren, indem es mit Wasser reagiert und dadurch Hydroxid-Ionen (OH-) produziert. Dies führt zu einem basischen pH-Wert der Lösung.
Auf der anderen Seite haben wir Ammoniumchlorid (NH4Cl), ein Salz der starken Säure Salzsäure (HCl) und der schwachen Base Ammoniak (NH3). Bei der Auflösung in Wasser entstehen Ammoniumionen (NH4+) und Chloridionen (Cl-). Das Ammoniumion hydrolysiert zu einigem Grad, wodurch Wasserstoffionen (H+) freigesetzt werden. Dies resultiert in einem sauren pH-Wert der Lösung.
Die Chemische Zusammensetzung von Salzen spielt daher eine große Rolle beim Bestimmen der endgültigen pH-Wert Messen.
Zusammenfassend lässt sich sagen, dass die Hydrolyse von Ionen eines Salzes den Säuregrad von Lösungen stark beeinflussen kann. Verständnis dieser Prozesse ermöglicht es, gezielt pH-Veränderungen in verschiedenen Anwendungen vorherzusagen und zu steuern. Beispielsweise wird dies bei der Neutralisation von Säuren eingesetzt, wo ein starkes pH-Gefälle ausgeglichen werden muss.
Beispiele für saure und basische Salze
Es gibt verschiedene Beispiele für saure und basische Salze, die in der Chemie häufig vorkommen und Anwendung finden.
Saure Salze entstehen oft durch die partielle Neutralisation einer mehrprotonigen Säure mit einer Base. Ein bekanntes saurer Salz ist Natriumhydrogensulfat (NaHSO4). Dieses Salz resultiert aus der Reaktion von Schwefelsäure mit Natronlauge, wobei nur ein Wasserstoffion neutralisiert wird. Saure Salze haben die Eigenschaft, in wässriger Lösung ein saures Milieu zu erzeugen.
Ein weiteres Beispiel ist Ammoniumchlorid (NH4Cl). Es entsteht durch die Neutralisation von Ammoniak (NH3) mit Salzsäure (HCl). In Wasser hydrolysiert es teilweise und setzt dabei Protonen frei, was den pH-Wert der Lösung senkt.
Auf der anderen Seite stehen die basischen Salze. Diese bilden sich üblicherweise durch die unvollständige Neutralisation starker Basen durch schwache Säuren. Ein häufiger Vertreter ist Natriumcarbonat (Na2CO3), auch bekannt als Soda. In wässriger Lösung trifft man bei diesem Salz auf eine alkalische Reaktion, da Carbonationen in einer Hydrolysereaktion Hydroxidionen freisetzen.
Ein weiteres Beispiel für ein basisches Salz ist Kaliumcyanid (KCN). Bei dieser Verbindung kommt es ebenfalls zur Hydrolyse, wodurch Hydroxidionen entstehen und somit der pH-Wert steigt, was das Lösungsmilieu basisch macht.
Salze spielen also eine zentrale Rolle bei Änderungen des Säuregrads von Lösungen. Sie können sowohl saure als auch basische Eigenschaften besitzen, abhängig von der jeweiligen chemischen Zusammensetzung und den beteiligten Ionen.
| Salz | Typ | Hydrolyse-Eigenschaft |
|---|---|---|
| Ammoniumacetat (NH4CH3COO) | Neutrales Salz | Keine Hydrolyse |
| Bariumsulfat (BaSO4) | Schwerlöslich | Keine signifikante Hydrolyse |
| Aluminiumsulfat (Al2(SO4)3) | Saures Salz | Hydrolysiert zu Al3+ und H3O+ |
Einfluss verschiedener Ionen auf den pH-Wert
Der pH-Wert einer Salzlösung hängt stark von den Ionen ab, die in der Lösung vorhanden sind. Kationische und anionische Bestandteile des Salzes spielen dabei eine entscheidende Rolle. Zum Beispiel beeinflusst das Chlorid-Anion (Cl–) aus Natriumchlorid (NaCl) kaum den pH-Wert einer Lösung, da es sich nicht signifikant hydrolysiert.
Anders ist es bei Salzen wie Ammoniumchlorid (NH4Cl). Das Ammonium-Ion (NH4+) reagiert mit Wasser unter Freisetzung von Protonen (H+), wodurch die Lösung saurer wird. In dem Fall spricht man von einem sauren pH-Wert.
Ein weiteres Beispiel wären Salze wie Natriumacetat (CH3COONa). Das Acetat-Ion (CH3COO–) kann Hydroxid-Ionen (OH–) freisetzen, was zu einer Alkalischen Reaktion führt. Solche Salze erhöhen den basischen Charakter einer Lösung.
Zusammengefasst spielt die chemische Zusammensetzung von Salzen eine große Rolle für ihren Einfluss auf den Säuregrad von Lösungen. Durch die Neutralisation von Säuren oder Basen können Salze erhebliche Veränderungen im pH-Wert hervorrufen. Daher ist die Messung und genaue Bestimmung dieser Werte essenziell, insbesondere in Laborumgebungen und industriellen Anwendungen.
Zur genauen pH-Wert Bestimmung verwendet man oft Elektroden oder Indikatorlösungen. Diese Methoden helfen, den exakten pH-Wert von verschiedenen Lösungen festzustellen und gegebenenfalls anzupassen.
Messmethoden und praktische Bestimmung
Die pH-Wert Bestimmung von Salzlösungen kann durch verschiedene Methoden erfolgen. Eine der einfachsten und gebräuchlichsten Methoden ist die Nutzung von pH-Indikatoren. Diese chemischen Substanzen ändern ihre Farbe in Abhängigkeit vom Säuregrad von Lösungen. Für eine genauere Messung werden jedoch pH-Meter eingesetzt, die elektrische Potentialdifferenzen messen und in pH-Einheiten umwandeln.
Ein pH-Meter besteht aus einer Glaselektrode und einer Bezugselektrode, die in die Salzlösung getaucht werden. Das Gerät misst die Spannung zwischen diesen Elektroden und berechnet daraus den pH-Wert. Bei der Kalibrierung des pH-Meters verwendet man Pufferlösungen mit bekannten pH-Werten, um präzise Ergebnisse zu gewährleisten. Dies erfordert eine sorgfältige Handhabung und regelmäßige Wartung des Geräts.
Neben der direkten Messung gibt es auch andere Analysenmethoden wie die Titration, bei der der pH-Wert Messen zur Bestimmung der Konzentration von Säuren oder Basen in Lösungen genutzt wird. Dabei wird eine bekannte Menge eines Titriermittels zugegeben und die Veränderung im pH-Wert aufgezeichnet, bis eine Neutralisation von Säuren oder Basen erreicht ist. Diese Methode ermöglicht nicht nur die Bestimmung des pH-Werts, sondern auch die Analyse der Chemische Zusammensetzung von Salzen.
Es gibt verschiedene Methoden zur Messung des pH-Werts von Salzen. Eine gängige Methode ist die Verwendung eines pH-Meters, das den pH-Wert der Salzlösung direkt misst. Eine andere Methode ist die Verwendung von Indikatorpapier, das Farbänderungen je nach dem sauren oder basischen Charakter der Lösung zeigt. Praktisch kann der pH-Wert von Salzen durch Zugabe von Wasser zur Salzprobe und Messung des resultierenden pH-Werts bestimmt werden.
Anwendung und Bedeutung in der Chemie
- Der pH-Wert von Salz ist wichtig für die Herstellung von Pufferlösungen in der Chemie.
- Er spielt eine Rolle bei der Neutralisation von Säuren und Basen.
- Der pH-Wert von Salz kann auch Auswirkungen auf chemische Reaktionen und Prozesse haben.
Der pH-Wert von Salz hat verschiedene Anwendungsfälle in der Chemie. Hier sind einige Beispiele:
- Herstellung von Pufferlösungen
- Neutralisation von Säuren und Basen
- Kontrolle chemischer Reaktionen
- Einstellung von pH-Werten in industriellen Prozessen
- Analyse von Salzlösungen in Laboruntersuchungen
- Regulierung des pH-Werts in der Lebensmittelindustrie
- Anpassung des pH-Werts in der Landwirtschaft für optimales Pflanzenwachstum
- Verwendung in der pharmazeutischen Industrie zur Herstellung von Medikamenten
- Bestimmung des pH-Werts von Bodenproben für die Landwirtschaft
In der Chemie haben Salze vielfältige Anwendungen und eine große Bedeutung. Sie spielen eine zentrale Rolle in vielen Reaktionen und Prozessen, insbesondere bei der Neutralisation von Säuren. Durch die Neutralisationsreaktion entstehen meistens Wasser und ein Salz, was oft in industriellen Verfahren genutzt wird.
Salze sind auch grundlegende Komponenten in verschiedenen analytischen Techniken. Zum Beispiel dient die pH-Wert Bestimmung einer Lösung als wichtige Methode zur Charakterisierung ihrer chemischen Eigenschaften. Hierbei kann man mithilfe von Indikatoren oder pH-Metern den Säuregrad von Lösungen messen und somit Rückschlüsse auf die Konzentrationen von H⁺- und OH⁻-Ionen ziehen.
Ein weiteres bedeutendes Anwendungsgebiet ist die Elektrolyse. Bei der Elektrolyse von Salzen lassen sich Metalle und Nichtmetalle in reiner Form gewinnen. Ein klassisches Beispiel ist die Gewinnung von Chlor und Natriumhydroxid aus Kochsalz (NaCl).
Darüber hinaus fungieren einige Salze als Elektrolyte in Batterien und Akkumulatoren. Diese Salze ermöglichen den Fluss elektrischer Ladung zwischen Anode und Kathode, indem sie Ionen in der Lösung bereitstellen. So tragen sie maßgeblich zur Leistungsfähigkeit dieser Energiespeicher bei.
Die Chemische Zusammensetzung von Salzen lässt sie zudem für Umweltanwendungen wie die Entsalzung von Wasser nützlich werden. Durch Ionenaustauschverfahren können unerwünschte Mineralien herausgefiltert werden, was die Nutzung von salzhaltigem Wasser verbessert.
Schließlich findet man Salze häufig in biologischen Systemen. Sie regeln etwa den osmotischen Druck in Zellen und ermöglichen enzymatische Aktivitäten, die wiederum essenziell sind für zahlreiche biochemische Prozesse.