HCl Säure
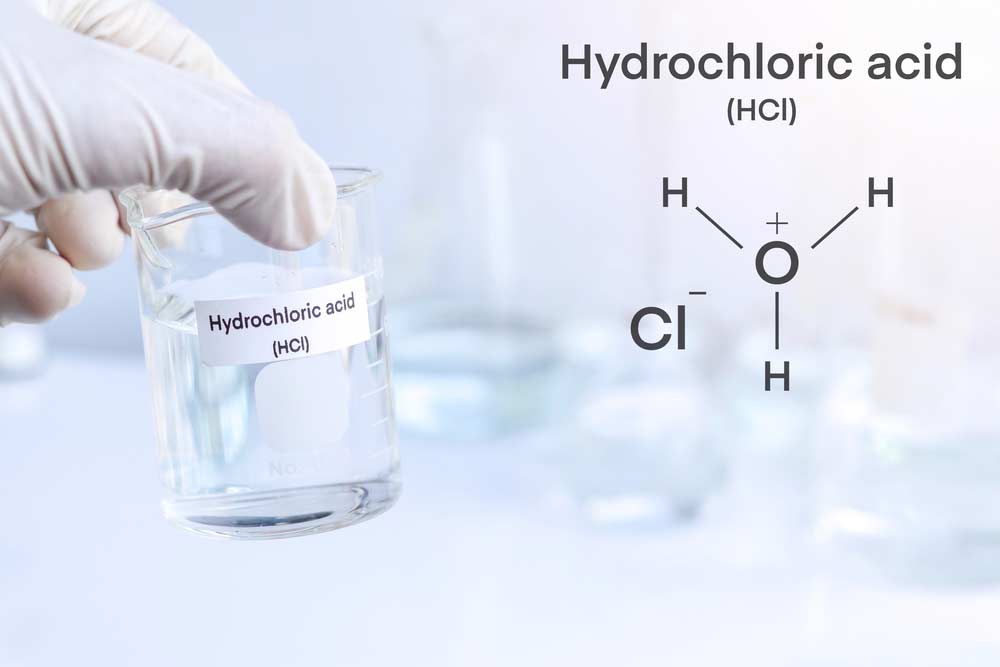
Salzsäure (HCl) ist eine der grundlegendsten und am häufigsten verwendeten Chemikalien in der modernen Industrie und Wissenschaft. Mit der Summenformel von Salzsäure HCl ist diese starke Säure ein wichtiger Bestandteil vieler chemischer Prozesse. Sie ist bekannt für ihre hohe Reaktivität, die sie zu einem vielseitigen Werkzeug in verschiedenen Anwendungen macht. Salzsäure (HCl) ist keine eigenständige Substanz im Periodensystem der Elemente, da sie ein Molekül aus Wasserstoff und Chlor ist. Wasserstoff (H) befindet sich in der ersten Hauptgruppe und Chlor (Cl) in der siebten Hauptgruppe des Periodensystems.
Die Formel der Salzsäure zeigt auf eindrucksvolle Weise die einfache, aber wirkungsvolle Struktur: ein Wasserstoffatom verbunden mit einem Chloratom. Diese Verbindung gibt ihr einzigartige chemische Eigenschaften, wie einen niedrigen pH-Wert und die Fähigkeit, Metalle aufzulösen. Entsprechend ihrer Reaktionsgleichung kann sie leicht mit Basen zu Salzen und Wasser reagieren, was viele industrielle Prozesse erleichtert.
Zusätzlich zur industriellen Nutzung findet Salzsäure Anwendung in der Lebensmittelindustrie, bei der Metallbearbeitung und in der Laborchemie. Ihre Vielseitigkeit und Wirksamkeit machen sie zu einem unverzichtbaren Stoff in zahlreichen Bereichen. Doch trotz all dieser Vorteile sind beim Umgang mit HCl immer strenge Sicherheitsmaßnahmen notwendig, um Risiken zu minimieren und den Umwelteinfluss möglichst gering zu halten.
Das Wichtigste in Kürze
- Salzsäure (HCl) ist eine starke, anorganische Säure, die in vielen industriellen und wissenschaftlichen Anwendungen genutzt wird.
- HCl reagiert in Wasser zu Hydronium- und Chlorid-Ionen und hat einen sehr niedrigen pH-Wert.
- Industrielle Herstellung erfolgt durch die Synthese von Wasserstoff und Chlor zu gasförmigem Chlorwasserstoff.
- In der Metallbearbeitung wird HCl zum Beizen und Ätzen von Metallen verwendet.
- Sicherheitsvorkehrungen sind essentiell, um gesundheitliche Risiken und Umweltschäden zu vermeiden.
Salzsäure, chemisch bekannt als HCl, ist eine äußerst wichtige Säure in der Chemie. Sie besteht aus Wasserstoff- und Chloratomen und ist eine starke anorganische Säure. Aufgrund ihrer vielfältigen Verwendungen in verschiedenen chemischen Prozessen ist Salzsäure ein wesentlicher Bestandteil vieler Labor- und Industrieanwendungen.
Steckbrief Salzsäure
| Salzsäure | Eigenschaften und Verwendung |
|---|---|
| Chemische Formel | HCl |
| Aussehen | Farblose bis gelbliche Flüssigkeit, stechender Geruch |
| Säurestärke | Starke anorganische Säure, reagiert mit vielen Stoffen |
| Verwendung | – Reinigung von Oberflächen, Entkalkung, pH-Regulierung – Beizmittel in der Metallverarbeitung – Lebensmittelindustrie zur Säureregulierung |
| Besondere Merkmale | – Wichtiger Bestandteil von Magensäure im Körper – Ätzend und reizend bei Kontakt mit Haut und Schleimhäuten |
| Herstellung | Durch Reaktion von Salz (NaCl) mit Schwefelsäure (H2SO4) |
| Löslichkeit | Gut in Wasser löslich, bildet Salzsäurelösung |
| Gefahrenhinweise | Ätzend für Haut und Augen, reizend für Atemwege |
| Industrielle Bedeutung | Wichtige Säure in vielen chemischen Prozessen zur Synthese und Reinigung |
| Gesundheitsrisiken | Bei unsachgemäßer Handhabung können Hautreizungen, Augenreizungen und Atemwegsprobleme auftreten |
Was ist Salzsäure?
Salzsäure, chemisch bekannt als HCl, ist eine starke anorganische Säure, die aus Wasserstoff- und Chloratomen besteht. Sie ist eine farblose bis gelbliche Flüssigkeit mit einem stechenden Geruch. Salzsäure findet breite Anwendung in der Industrie, z.B. für Reinigungszwecke, in der Metallverarbeitung, in der Lebensmittelindustrie und als pH-Regulator. In biologischen Systemen ist Salzsäure ein wichtiger Bestandteil der Magensäure und spielt eine Rolle bei der Verdauung.
Salzsäure Reaktionsgleichung
Bei der Reaktion von Natriumchlorid (NaCl) mit Schwefelsäure (H2SO4) entsteht Natriumsulfat (Na2SO4) und Salzsäure (HCl). Die Reaktionsgleichung für die Herstellung von Salzsäure durch die Reaktion von Natriumchlorid (NaCl) mit Schwefelsäure (H2SO4) lautet:
NaCl + H2SO4 -> Na2SO4 + HCl
Summenformel von Salzsäure
Die Summenformel von Salzsäure lautet HCl.
Chemische Formel von Salzsäure
Die chemische Formel von Salzsäure lautet HCl.
Molekülformel Salzsäure
Die Molekülformel von Salzsäure lautet HCl.
Salzsäure Strukturformel
Die Strukturformel von Salzsäure (HCl) zeigt die chemische Bindung zwischen einem Wasserstoffatom und einem Chloratom. Da es sich um eine einfache Verbindung handelt, wird sie in der Strukturformel als H-Cl dargestellt, wobei der Strich die Bindung zwischen den beiden Atomen darstellt.
Eigenschaften von Salzsäure
Salzsäure, auch bekannt als Chlorwasserstoff, ist eine äußerst starke anorganische Säure mit der chemischen Formel HCl. Sie ist eine farblose bis gelbliche Flüssigkeit mit einem stechenden Geruch. Salzsäure ist gut in Wasser löslich und bildet eine klare Lösung. Die Säurestärke von Salzsäure ist hoch, was sie zu einer ätzenden und reizenden Substanz macht. In der Industrie wird Salzsäure vielfältig eingesetzt, beispielsweise zur Reinigung, Entkalkung, pH-Regulierung und in der Metallverarbeitung.
Chemische Eigenschaften und molekulare Struktur von HCl
Was ist Salzsäure? Salzsäure oder HCl ist eine starke, anorganische Säure, deren Summenformel von Salzsäure HCl lautet. Die Strukturformel zeigt eine direkte Bindung zwischen Wasserstoff (H) und Chlor (Cl). Diese Verbindung wird auch als Salzsäure Strukturformel bezeichnet und spielt in der Chemie eine wichtige Rolle.
Eines der auffälligsten Eigenschaften von HCl ist sein Siedepunkt: Salzsäure beginnt bei etwa -85°C zu sieden. Im gasförmigen Zustand besteht HCl aus einzelnen Molekülen, die jeweils aus einem Wasserstoff- und einem Chloratom bestehen. Im flüssigen Zustand löst sich das Gas bereitwillig in Wasser auf, wobei es stark exotherm reagiert und eine klare Lösung bildet.
Wichtige chemische Eigenschaften von Salzsäure umfassen ihre hohe Dissoziation in wässriger Lösung sowie ihr Verhalten als starke Säure. In Wasser zerfällt HCl vollständig in Hydronium-Ionen (H₃O⁺) und Chlorid-Ionen (Cl⁻). Diese Ionenbildung ist entscheidend für den stark sauren pH-Wert der Salzsäurelösung.
Schreiben wir die Salzsäure Reaktionsgleichung wie folgt auf:
HCl + H₂O → H₃O⁺ + Cl⁻
Die Reaktionen von Salzsäure mit Metallen sind ebenfalls bedeutsam. Beispielsweise reagiert sie mit Zink unter Freisetzung von Wasserstoffgas:
Zn + 2HCl → ZnCl₂ + H₂
Diese Reaktion verdeutlicht die aggressiven Korrosionsfähigkeiten von HCl und erklärt einen Teil ihrer nützlichen Anwendungen in der Metallverarbeitung und -reinigung.
„Chemie ist die Wissenschaft von den Stoffen, ihrem Aufbau, ihren Eigenschaften und ihren Umwandlungen.“ – Justus von Liebig
| Eigenschaft | Beschreibung |
|---|---|
| Summenformel von Salzsäure | HCl |
| Strukturformel | Ein Wasserstoffatom verbunden mit einem Chloratom |
| Siedepunkt Salzsäure | -85°C |
| Dissoziation in Wasser | HCl → H₃O⁺ + Cl⁻ |
| Reaktion mit Zink | Zn + 2HCl → ZnCl₂ + H₂ |
| pH-Wert | Sehr niedrig, starke Säure |
Industrielle Herstellung von Salzsäure
Ein gängiges Verfahren zur industriellen Herstellung von Salzsäure ist die Synthese aus Wasserstoff und Chlor. Dazu werden molekularer Wasserstoff (H₂) und Chlor (Cl₂) in einem speziellen Reaktor bei hoher Temperatur und unter kontrollierten Bedingungen zusammengeführt.
Wasserstoff und Chlor reagieren dabei zu gasförmigem Chlorwasserstoff (HCl), das sich anschließend in Wasser löst, um konzentrierte Salzsäure zu bilden. Dieser Prozess wird oft als Chlor-Wasserstoff-Synthese bezeichnet. Eine typische chemische Gleichung für diesen Vorgang lautet:
H₂ + Cl₂ → 2 HCl
Um eine hohe Reinheit der Salzsäure zu garantieren, sind sorgfältige Überwachung der Temperatur und des Drucks sowie optimale Reaktionsbedingungen notwendig. Nach der Reaktion wird das entstandene Gas in Wasser absorbiert, wobei eine exotherme Reaktion stattfindet und Wärme freigesetzt wird.
Eine alternative Methode ist die Aufbereitung von Nebenprodukten, die bei anderen industriellen Prozessen entstehen. Beispielsweise fällt bei der PVC-Herstellung Chlorwasserstoff an, der durch Absorption in Wasser ebenfalls in Salzsäure umgewandelt wird.
Die industrielle Produktion von Salzsäure ist entscheidend für viele Anwendungsbereiche, darunter die Verwendung von Salzsäure in der Lebensmittelindustrie, die Metallbearbeitung sowie die Reinigung und Desinfektion. Sie erfordert jedoch strenge Sicherheitsmaßnahmen, da Chlor hochgiftig und korrosiv ist.
Nutzung in der Metallbearbeitung
Die Nutzung von Salzsäure in der Metallbearbeitung spielt eine wichtige Rolle. HCl, die Formel der Salzsäure, wird oft zum Beizen von Metallen verwendet, um die Oberfläche zu reinigen und Oxide zu entfernen. Dies ist besonders bei Stahl und Eisen notwendig.
Durch das Beizverfahren werden Rost und Verunreinigungen entfernt, was die Qualität des Endprodukts erheblich erhöht. Ein Beispiel für eine gängige Anwendung ist in der Stahlindustrie, wo Millionen Tonnen Siedepunkt Salzsäure jährlich verbraucht werden. Die chemische Reaktion, bei der Metalloxide durch HCl gelöst werden, lässt sich deutlich anhand einer Salzsäure Reaktionsgleichung beobachten.
Neben dem Beizen wird Salzsäure auch beim Ätzen von Metallen eingesetzt, ein Prozess, der häufig in der Herstellung von Elektronikplatinen vorkommt. Dabei dient die Säure dazu, unerwünschte Schichten vom Metall abzutragen und präzise Strukturen zu schaffen. Solche Anwendungen erfordern genaue Kenntnisse über die Summenformel von Salzsäure und ihre chemischen Eigenschaften, um optimale Ergebnisse zu erzielen.
Ein zusätzlicher Vorteil von Salzsäure in der Metallverarbeitung sind ihre Kosteneffizienz und Verfügbarkeit, was sie zu einem bevorzugten Mittel macht. Dennoch sollte man die Gefahren und Sicherheit im Umgang mit Salzsäure stets beachten. Das Tragen geeigneter Schutzkleidung und die richtige Lagerung sind essenziell, um Unfälle zu vermeiden.
Anwendung in der Lebensmittelindustrie
Salzsäure (HCl) spielt eine bedeutende Rolle in der Lebensmittelindustrie. Sie wird häufig zur Säureregulierung eingesetzt, um den pH-Wert von Produkten zu steuern. Dies ist besonders wichtig für die Konservierung und Stabilisierung von Lebensmitteln. Das Justieren des pH-Werts kann das Wachstum unerwünschter Mikroorganismen verhindern und somit die Haltbarkeit verlängern.
Ein weiteres Anwendungsgebiet ist die Hydrolyse von Proteinen. Durch den Einsatz von Salzsäure können Proteine leichter abgebaut werden, was für die Herstellung bestimmter Produkte von Bedeutung ist. Auch bei der Produktion von Gelatine findet HCl Anwendung, da es hilft, die körnige Struktur zu brechen und ein glatteres Endprodukt zu erhalten.
In der Zuckerindustrie wird Salzsäure verwendet, um den Rohzucker zu reinigen. Die Chemikalie hilft dabei, Verunreinigungen zu entfernen und eine höhere Qualität des Zuckers zu gewährleisten. Dies verbessert nicht nur den Geschmack, sondern auch die Optik des finalen Produkts.
Der professionelle Einsatz von Salzsäure erfordert strikte Sicherheitsmaßnahmen. Da es sich um eine sehr aggressive Säure handelt, sind geeignete Schutzkleidung und Vorkehrungen notwendig, um gesundheitliche Gefahren zu minimieren. Schließlich gilt es, sowohl die Mitarbeiter als auch die Konsumenten vor möglichen Risiken zu schützen.
Die vielfältigen Anwendungen von Salzsäure zeigen, wie breit gefächert ihre Einsatzmöglichkeiten sind und welche entscheidende Rolle sie in verschiedenen Prozessen der Lebensmittelproduktion spielt.
Bedeutung in der Laborchemie
In der Laborchemie spielt Salzsäure (HCl) eine zentrale Rolle. Durch ihre starke Säurewirkung ist sie in zahlreichen chemischen Reaktionen und Experimenten unverzichtbar. Die Summenformel von Salzsäure, HCl, deutet auf die einfache Struktur hin: Ein Chloratom ist mit einem Wasserstoffatom verbunden. Diese einfache Konstellation verleiht HCl seine charakteristischen Eigenschaften.
HCl wird häufig verwendet, um den pH-Wert einer Lösung anzupassen. Aufgrund ihrer hohen Löslichkeit in Wasser lässt sich der pH-Wert sehr präzise steuern. Darüber hinaus wird Salzsäure für die Titration genutzt, ein Verfahren, bei dem die Konzentration einer Säure oder Base ermittelt wird. Die Genauigkeit bei diesen Prozessen macht HCl zu einem favorisierten Hilfsmittel.
Weiterhin dient Salzsäure zum Aufschluss von Proben, indem sie komplexe Substanzen zersetzt und in einfachere Bestandteile überführt. Besonders wichtig ist dies in der Metallanalytik, wo HCl Metalle aus mineralischen Rohstoffen löst. Hierbei reagiert die Säure mit den Metallen und es entstehen wasserlösliche Metallchloride.
Abgesehen davon findet man HCl in der Präparation von Salzen und als Katalysator für organische Synthesen. In der Forschung werden kleine Mengen an HCl oft dazu verwendet, Reaktionsbedingungen für neue chemische Verbindungen zu testen. Die vielseitigen Einsatzmöglichkeiten in der Laborchemie machen HCl zu einem unentbehrlichen Reagenz im wissenschaftlichen Alltag.
| Eigenschaft | Verwendung | Beschreibung |
|---|---|---|
| Summenformel | Grundanalyse | HCl |
| Siedepunkt | Temperaturstudien | -85°C |
| Reaktion mit Metallen | Metallbearbeitung | Zn + 2HCl → ZnCl₂ + H₂ |
Sicherheitsvorkehrungen und Schutzmaßnahmen
Im Umgang mit HCl, der Formel der Salzsäure, sind umfangreiche Sicherheitsvorkehrungen und Schutzmaßnahmen unbedingt notwendig. Als stark korrosives Mittel kann sie schwere Verätzungen auf Haut und Augen verursachen und darf daher nicht ohne geeignete Schutzkleidung gehandhabt werden.
Persönliche Schutzausrüstung schließt dabei das Tragen von säureresistenten Handschuhen, Schutzbrillen und Laborkitteln ein. Auch eine chemikalienbeständige Schürze kann sinnvoll sein, um die Kleidung zu schützen. Arbeiten sollten wenn möglich unter einem Abzug erfolgen, um Dämpfe sicher abzusaugen.
Sollte doch einmal Kontakt mit der Haut oder den Augen auftreten, ist sofortiges Spülen mit reichlich Wasser unerlässlich. Eine augenärztliche Untersuchung sollte möglichst schnell erfolgen. Inhalation der Dämpfe von HCl kann zudem die Atemwege reizen; daher ist für ausreichende Belüftung zu sorgen.
Chemische Eigenschaften von Salzsäure, wie ihre starke Reaktivität, machen sie zu einem vielseitigen Hilfsmittel in Laboren, allerdings bedarf es strikter Sicherheitsregeln. Kommt es zu Verschüttungen, müssen diese mit neutralisierenden Mitteln wie Natriumbikarbonat behandelt und gründlich gereinigt werden.
Eine sichere Lagerung beinhaltet die Aufbewahrung in gekennzeichneten, verschlossenen Behältern, fern von Unbefugten und potenziellen Zündquellen. Notfallpläne und eine gute Ausbildung der Anwender sind ein wesentlicher Bestandteil eines sicheren Umgangs mit dieser Substanz.
Umwelteinflüsse und Entsorgung von HCl
Die Entsorgung von HCl erfordert besondere Sorgfalt, da sie erhebliche Umweltrisiken mit sich bringt. HCl ist eine starke Säure mit einem niedrigen pH-Wert und kann Wasserorganismen schädigen sowie Böden und Gewässer verunreinigen.
Es gibt strikte gesetzliche Vorschriften zur Entsorgung von Salzsäure. Industrielle Abwässer, die HCl enthalten, müssen oft neutralisiert werden, bevor sie in das Abwassersystem eingeleitet werden dürfen. Diese Neutralisation erfolgt häufig durch Zugabe basischer Substanzen wie Natriumhydroxid (NaOH) oder Kalziumkarbonat (CaCO3). Dadurch wird der pH-Wert angehoben und die schädlichen Effekte auf die Umwelt werden reduziert.
Ein besonderer Diskussionspunkt bei der Entsorgung von HCl ist die Luftemission. Bei der Produktion und Handhabung kann Chlorwasserstoffgas freigesetzt werden, welches stark reizend ist und zu Atemwegsproblemen führen kann. Betriebsstätten müssen daher mit effektiven Absauganlagen und Filtersystemen ausgestattet sein, um die Freisetzung von Gasen zu minimieren.
Neben industrieller Nutzung findet HCl auch in Haushaltsreinigern Anwendung. Hier gilt: Keine großen Mengen von Restreiniger einfach in den Abfluss geben. Für Privathaushalte bieten sich Sammelstellen für Problemmüll an, um den korrekten Umgang mit chemischen Restprodukten sicherzustellen.