Grundgesetze der Chemie
Die chemischen Grundgesetze sind die Bausteine unseres Verständnisses von Chemie. Sie erklären, wie Atome und Moleküle interagieren und welche Prinzipien diesen Reaktionen zugrunde liegen. Diese Gesetze helfen dabei, komplexe chemische Prozesse zu vereinfachen und verständlicher zu machen.
Ein grundlegendes Konzept ist das Gesetz der Erhaltung der Masse, welches besagt, dass bei chemischen Reaktionen keine Masse verloren geht. Darüber hinaus beschreibt das Gesetz der konstanten Proportionen, dass eine Verbindung immer aus den gleichen Elementen in festen Massenverhältnissen besteht. Hinzu kommt das Gesetz der multiplen Proportionen, welches zeigt, dass sich Elemente in verschiedenen Verhältnissen verbinden können, um verschiedene Verbindungen zu bilden.
Diese und weitere wichtige Gesetze wie das Avogadro-Gesetz und das Idealgasgesetz spielen eine zentrale Rolle in der Chemie. Sie ermöglichen es uns, präzise Reaktionsgleichungen aufzustellen und die Stöchiometrie chemischer Reaktionen zu verstehen. Dies wiederum hilft uns, molekulare Strukturen sowie chemische Bindungen besser zu begreifen und deren Verhalten vorherzusagen.
Das Wichtigste in Kürze
- Das Gesetz der Erhaltung der Masse besagt, dass die Gesamtmasse bei chemischen Reaktionen konstant bleibt.
- Das Gesetz der konstanten Proportionen beschreibt fixe Massenverhältnisse in chemischen Verbindungen.
- Das Gesetz der multiplen Proportionen zeigt einfache ganzzahlige Verhältnisse in verschiedenen Verbindungen.
- Das Avogadro-Gesetz verbindet Gasvolumina mit der Anzahl der Moleküle bei gleichen Bedingungen.
- Das allgemeine Gasgesetz (PV = nRT) beschreibt das Verhalten idealer Gase.
Die chemischen Grundgesetze umfassen grundlegende Prinzipien und Gesetzmäßigkeiten in der Chemie, die die Verhalten von Stoffen und Reaktionen beschreiben. Dazu gehören das Gesetz der Massenerhaltung (Gesetz von Lavoisier), das Gesetz der konstanten Proportionen (Gesetz von Proust) und das Gesetz der multiplen Proportionen (Gesetz von Dalton). Diese Gesetze bilden die Basis für das Verständnis der chemischen Reaktionen, Stoffumwandlungen und die quantitative Analyse in der Chemie.
Gesetz der Erhaltung der Masse
Das Gesetz der Erhaltung der Masse ist ein grundlegendes Prinzip in der Chemie, das besagt, dass die Gesamtmasse der Reaktanten gleich der Gesamtmasse der Produkte einer chemischen Reaktion ist. Dies bedeutet, dass während eines chemischen Vorgangs keine Masse verloren geht und auch nicht erschaffen wird. Dieses Gesetz wurde erstmals von Antoine Lavoisier im 18. Jahrhundert formuliert.
Ein praktisches Beispiel für dieses Gesetz ist die Verbrennung von Holz. Wenn Holz verbrannt wird, scheint es, als ob seine Masse verschwindet. In Wirklichkeit jedoch werden die Atome des Holzes lediglich zu neuen Verbindungen umgewandelt wie Kohlendioxid (CO₂) und Wasser (H₂O). Die Gesamtmasse dieser Produkte entspricht genau der ursprünglichen Masse des Holzes sowie dem Sauerstoff aus der Luft, der an der Reaktion beteiligt war.
In der Stöchiometrie und bei Reaktionsgleichungen spielt dieses Gesetz eine zentrale Rolle. Wissenschaftler nutzen es, um chemische Reaktionen präzise zu berechnen und die Massen von Edukten und Produkten korrekt abzuschätzen. Mit Hilfe des Gesetzes der Erhaltung der Masse können sie sicherstellen, dass ihre Gleichungen ausgewogen und korret sind.
Dieses Prinzip findet nicht nur in klassischen chemischen Reaktionen Anwendung, sondern auch in moderneren Bereichen wie der Nuklearchemie und Thermodynamik. Es bildet die Grundlage vieler anderer Gesetze und Theorien in der Chemie, einschließlich der Atomtheorie und der Elektronenkonfiguration.
Die Materie unterliegt bei chemischen Reaktionen der Erhaltung der Masse und der Energie; nichts entsteht aus dem Nichts, und nichts verschwindet ins Nichts. – Antoine Lavoisier
| Gesetz | Beschreibung |
|---|---|
| Gesetz der Erhaltung der Masse | Die Gesamtmasse der Reaktanten ist gleich der Gesamtmasse der Produkte einer chemischen Reaktion. |
| Gesetz der konstanten Proportionen | Eine Verbindung besteht immer aus den gleichen Elementen in festen Massenverhältnissen. |
| Gesetz der multiplen Proportionen | Elemente können sich in verschiedenen Verhältnissen verbinden, um verschiedene Verbindungen zu bilden. |
| Avogadro-Gesetz | Unter gleichen Bedingungen (Temperatur und Druck) enthalten gleiche Volumina verschiedener Gase die gleiche Anzahl von Molekülen. |
| Allgemeines Gasgesetz | Verknüpft Druck, Volumen und Temperatur eines idealen Gases in einer mathematischen Beziehung. |
| Raoultsches Gesetz | Der Dampfdruck einer Lösung ist proportional zum Molenbruch des Lösungsmittels. |
| Daltonsches Gesetz | In einem Gemisch aus nicht-reaktiven Gasen ist der Gesamtdruck die Summe der Partialdrücke der einzelnen Gase. |
Gesetz der konstanten Proportionen
Das Gesetz der konstanten Proportionen, auch bekannt als Proustsches Gesetz, ist ein grundlegendes Prinzip in der Chemie. Es besagt, dass eine chemische Verbindung stets die gleichen Elemente und diese Elemente immer im gleichen Massenverhältnis enthält. Dies bedeutet, dass bei einer Verbindung wie Wasser (H₂O) das Verhältnis von Wasserstoff zu Sauerstoff immer 2:1 bleibt, unabhängig davon, woher das Wasser stammt oder wie es hergestellt wurde.
Dieses Gesetz widerspricht der Vorstellung, dass die Zusammensetzung chemischer Verbindungen variieren kann. So können wir nachvollziehen, warum Atome und Moleküle bestimmte Eigenschaften aufweisen und wie verschiedene chemische Reaktionen vorhersehbar werden.
In der historischen Entwicklung war das Gesetz der konstanten Proportionen entscheidend für die Formulierung des Atomtheorie. Es zeigte, dass chemische Bindungen konsistent sind und brachte damit eine Ordnung und Vorhersagbarkeit in die chemische Forschung.
Dabei wurden auch Begriffe wie die Stöchiometrie eingeführt, um die genauen Mengenverhältnisse in chemischen Reaktionen zu beschreiben. Diese Erkenntnisse führten zur Etablierung weiterer Gesetze wie dem Gesetz der multiplen Proportionen, welches besagt, dass sich Elemente in unterschiedlichen Massenverhältnissen verbinden können, um verschiedene Verbindungen zu bilden. Diese Entdeckungen legten den Grundstein für viele moderne Forschungen und Anwendungen in der Chemie, einschließlich der Analyse von chemischen Bindungen und der Bestimmung der Reaktionsgleichungen.
Zusammenfassend lässt sich sagen, dass das Gesetz der konstanten Proportionen einen wesentlichen Beitrag zum Verständnis von chemischen Verbindungen leistete. Es half, die Vorhersagekraft von chemischen Prozessen zu verbessern und lieferte grundlegende Erkenntnisse über die Natur chemischer Substanzen.
Gesetz der multiplen Proportionen
Das Gesetz der multiplen Proportionen ist ein fundamentales Prinzip in der Chemie, das auf den bahnbrechenden Arbeiten von John Dalton zurückgeht. Dieses Gesetz besagt, dass wenn zwei Elemente mehrere Verbindungen miteinander eingehen, die Massen dieser Elemente in einem einfachen numerischen Verhältnis zueinander stehen.
Um dies besser zu veranschaulichen, betrachten wir die chemischen Reaktionen zwischen Stickstoff und Sauerstoff. Die beiden Elemente können verschiedene Oxide bilden: N₂O, NO, NO₂ und N₂O₅. In jeder dieser Verbindungen kombinieren sich Stickstoff und Sauerstoff in verschiedenen Proportionen. Dabei zeigt sich, dass die Massenanteile des einen Elements zum anderen in einem ganzen Zahlenverhältnis stehen.
Ein Beispiel: Im Stickstoffdioxid (NO₂) beträgt das Massenverhältnis von Stickstoff zu Sauerstoff etwa 14:32 oder vereinfacht 7:16. Vergleichen wir dies mit Distickstoffpentoxid (N₂O₅), so ergibt sich ein Massenverhältnis von Stickstoff zu Sauerstoff von ungefähr 28:80 oder vereinfacht ebenfalls im Verhältnis von 7:20.
Dieses Gesetz unterstützt maßgeblich die Theorie von Atomen und Molekülen, wie sie in der modernen Chemie verstanden wird. Es hilft bei der Bestimmung der chemischen Formeln und ermöglicht eine präzise Vorhersage von Produktmengen in Stöchiometrie-Berechnungen. Das Verständnis dieses Prinzips ist nicht nur für theoretische Überlegungen hilfreich, sondern auch praktisch relevant, beispielsweise in der Synthese neuer Stoffe oder bei der detaillierten Analyse bestehender Verbindungen.
Avogadro-Gesetz und Molkonzept
Das Avogadro-Gesetz ist ein fundamentales Prinzip in der Chemie und besagt, dass gleiche Volumina von Gasen bei gleicher Temperatur und gleichem Druck die gleiche Anzahl an Molekülen enthalten. Dies bedeutet, dass das Volumen eines Gases direkt proportional zur Anzahl der Gasteilchen ist. Wenn also zwei verschiedene Gase dieselben Bedingungen aufweisen, haben sie auch die gleiche Anzahl von Teilchen.
Hieraus ergibt sich das Konzept des Mols, eine zentrale Einheit in der Stöchiometrie. Ein Mol entspricht der Anzahl von Atomen in genau zwölf Gramm Kohlenstoff-12 und umfasst etwa 6,022 x 10^23 Teilchen. Diese Zahl wird als die Avogadro-Zahl bezeichnet.
Das Molkonzept erleichtert das Verständnis von chemischen Reaktionen und deren Berechnungen erheblich. Beispielsweise können mit Hilfe des Mols die Mengenverhältnisse von Reaktanten und Produkten in einer Reaktionsgleichung einfach angegeben werden.
Wenn zum Beispiel Wasser (H2O) aus zwei Molekülen Wasserstoff (H2) und einem Molekül Sauerstoff (O2) entsteht, so kann man direkt sagen: Zwei Mol Wasserstoff reagieren mit einem Mol Sauerstoff zu zwei Mol Wasser. Das Wissen um das Avogadro-Gesetz und das Molkonzept ist somit unverzichtbar für die genaue Quantifizierung in der Chemie, insbesondere bei Fragen der Materiemengen in chemischen Reaktionen und Gasverhalten.
Zusammen helfen diese Grundprinzipien dabei, die Beziehung zwischen makroskopischen Messgrößen wie Masse und Volumen mit mikroskopischen Größen, nämlich der Welt der Atome und Moleküle, herzustellen und verständlich zu machen.
Allgemeines Gasgesetz
Das allgemeine Gasgesetz ist eine der grundlegendsten Gleichungen in der Chemie, insbesondere wenn es um das Verhalten idealer Gase geht. Es vereint die Boyle-Mariotte-Gesetz, das Gesetz von Gay-Lussac und das Avogadro-Gesetz zu einer einzigen, integralen Formel: PV = nRT. Hierbei stehen P für den Druck, V für das Volumen, n für die Stoffmenge, R für die universelle Gaskonstante und T für die Temperatur.
Eine der Hauptanwendungen des allgemeinen Gasgesetzes ist die Berechnung oder Vorhersage des Verhaltens von Gasen unter unterschiedlichen Bedingungen. So kann man mit dieser Formel beispielsweise ermitteln, wie sich der Druck eines Gases verändert, wenn dessen Temperatur erhöht wird oder welche Stoffmenge vorhanden ist, wenn Volumen und Temperatur bekannt sind.
Es ist wichtig zu betonen, dass das allgemeine Gasgesetz nur für ideale Gase exakt gilt. Reale Gase weichen davon bei hohen Drücken und niedrigen Temperaturen ab. Bei diesen Bedingungen berücksichtigen fortgeschrittenere Modelle, wie das Van-der-Waals-Gesetz, Wechselwirkungen zwischen den Molekülen stärker.
Durch die Kenntnis des allgemeinen Gasgesetzes und seiner Anwendungen können sowohl professionelle Chemiker als auch Lernende fundierte Aussagen über das Verhalten unterschiedlicher Gase treffen. Dabei spielt dieses Wissen nicht nur in der akademischen Forschung, sondern auch in industriellen Prozessen eine herausragende Rolle. Beispielsweise in der chemischen Industrie, wo Gase oft unter verschiedenen Bedingungen gehandhabt werden müssen, ist das Verständnis des Verhalten von entscheidender Bedeutung.
| Gesetz | Bedeutung | Beispiele |
|---|---|---|
| Gesetz der Erhaltung der Masse | Die Masse bleibt in einer chemischen Reaktion konstant. | Verbrennung von Holz: Holz + O₂ → CO₂ + H₂O |
| Gesetz der konstanten Proportionen | Ein chemisches Element kommt in festen Verhältnissen vor. | H₂O besteht immer aus Wasserstoff und Sauerstoff im Verhältnis 2:1. |
| Avogadro-Gesetz | Gleiche Volumina aller Gase haben die gleiche Teilchenzahl. | 1 Liter H₂ und 1 Liter O₂ enthalten die gleiche Anzahl Moleküle bei gleichen Bedingungen. |
Gesetz der äquivalenten Proportionen
Das Gesetz der äquivalenten Proportionen, auch als Gesetz der multiplen Proportionen bekannt, ist eine grundlegende Regel in der Chemie. Es besagt, dass wenn zwei Elemente mehrere Verbindungen miteinander eingehen, die Massen dieser beiden Elemente zu einander im Verhältnis kleiner ganzer Zahlen stehen. Dieses Gesetz baut auf den Prinzipien des Gesetzes der konstanten Proportionen und dem Gesetz der Erhaltung der Masse auf.
Ein Beispiel verdeutlicht dies: Betrachtet man Kohlenstoff und Sauerstoff, bilden sie sowohl Kohlenmonoxid (CO) als auch Kohlendioxid (CO₂). Im Kohlenmonoxid steht das Verhältnis der Masse von Kohlenstoff zu Sauerstoff bei 12:16. In Kohlendioxid beträgt das Verhältnis jedoch 12:32. Hier sieht man, dass das Verhältnis der Massen von Sauerstoff als 1:2 ausgedrückt werden kann, was einem einfachen ganzzahligen Verhältnis entspricht.
Dieses Prinzip unterstützt die Atomtheorie und liefert Beweise für das Vorhandensein diskreter Atome als Bausteine der Materie. Es legt nahe, dass chemische Reaktionen zwischen bestimmten festgelegten Mengen an Atome und Moleküle stattfinden, was Grundlage vieler chemischer Konzepte wie Stöchiometrie und Reaktionsgleichungen ist.
Zusammengefasst veranschaulicht das Gesetz der äquivalenten Proportionen, wie grundlegend es ist, chemische Bindungen und Zusammensetzungen genauer zu verstehen. Damit spielt es eine Schlüsselrolle im Bereich der modernen Chemie und untermauert viele daraus resultierende wissenschaftliche Entwicklungen.
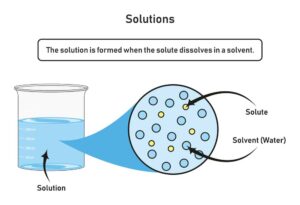
Raoultsches Gesetz
Im Bereich der Lösungskinetik und Thermodynamik spielt das Raoultsche Gesetz eine wichtige Rolle. Es beschreibt, wie der Dampfdruck einer Lösung in Bezug auf ihre Zusammensetzung funktioniert. Genauer gesagt, besagt es, dass der Partialdruck jeder Komponente in einem idealen Lösungsmittel proportional zu ihrem Molenbruch ist.
Das bedeutet, dass bei einer idealen Lösung der Gesamt-Dampfdruck sich aus den Beiträgen aller Komponenten zusammensetzt, wobei jede einzelne Komponente nach dem Produkt ihres Molenbruchs und ihres reinen Dampfdrucks beiträgt. Diese Beziehung kann mathematisch durch die Gleichung Pi = Xi · Pi dargestellt werden.
Hier steht Pi für den Partialdruck der Komponente i, Xi für ihren Molenbruch und Pi für den Dampfdruck der reinen Substanz. Dies ist besonders nützlich bei der Vorhersage des Verhaltens von Mischungen in verschiedenen chemischen Prozessen.
Chemische Reaktionen und Ionische Verbindungen, sowie Kovalente Verbindungen können direkte Anwendungen des Raoultschen Gesetzes erleben, insbesondere in Systemen, bei denen Lösungen eine bedeutende Rolle spielen. Durch das Verständnis dieses Gesetzes lassen sich viele Aspekte der Chemie, von der Stöchiometrie bis zur Löslichkeit und dem chemischen Gleichgewicht, besser erfassen.
In praktischer Hinsicht findet das Raoultsche Gesetz auch Anwendung bei der Bestimmung des Siedepunkts und des Gefrierpunkts von Lösungen, was wiederum eine wichtige Rolle bei der Herstellung verschiedenster Chemikalien und Produkte spielt.
Daltonsches Partialdruckgesetz
Das Daltonsches Partialdruckgesetz ist ein fundamentales Gesetz in der Chemie, das insbesondere bei Gasgemischen Anwendung findet. Es wurde von John Dalton im frühen 19. Jahrhundert formuliert und hilft dabei, das Verhalten von Gasen unter bestimmten Bedingungen zu verstehen.
Das Gesetz besagt, dass der Gesamtdruck eines Gasgemischs gleich der Summe der Partialdrücke der einzelnen Gase ist. Ein Partialdruck ist der Druck, den ein einzelnes Gas in einem Gemisch ausüben würde, wenn es allein das Volumen des Behälters beanspruchen würde. Hier sind einige wichtige Punkte:
- Der Partialdruck eines Gases hängt von seiner Menge (in Mol) und der Temperatur ab.
- Die Formel lautet: P_tot = P_1 + P_2 + P_3 + …, wobei P_tot der Gesamtdruck und P_1, P_2, P_3,… die Partialdrücke der einzelnen Gase sind.
- Dieses Gesetz spielt eine zentrale Rolle bei der Analyse von Gasgemischen und der Berechnung von Drücken in komplexen Systemen wie Atmosphären oder chemischen Reaktoren.
In praktischen Anwendungen wird oft das Idealgasgesetz herangezogen, welches das Verhältnis zwischen Druck, Volumen und Temperatur für ideale Gase beschreibt. Das Verständnis des Daltonschen Partialdruckgesetzes hilft auch beim Verständnis anderer Konzepte in der Chemie wie dem Avogadro-Gesetz, der Stöchiometrie und thermodynamischen Gesetzmäßigkeiten.
Zusätzlich unterstützt dieses Gesetz Chemiker dabei, die Wechselwirkungen zwischen verschiedenen Atomen und Molekülen in einer Mischung besser zu analysieren und das Verhalten solcher Systeme unter variablen Bedingungen vorherzusagen. Dies führt zu einem tiefergehenden Verständnis chemischer Reaktionen und ihrer Dynamik, einschließlich der Berücksichtigung der Elektronenkonfiguration und Isotope.
Wenn man die Prinzipien des Daltonschen Partialdruckgesetzes anwendet, lassen sich auch differenzierte Modelle zur Löslichkeit und zum chemischen Gleichgewicht ableiten, was wiederum zu verbesserten Methoden in der Synthese und Analyse beiträgt, sei es in der industriellen Produktion oder in wissenschaftlichen Untersuchungen.