Was ist die Mohrsche Titration? Ein anorganisches Analyseverfahren zur Bestimmung von Chloridionen
Die Mohrsche Titration ist ein bewährtes Verfahren zur Bestimmung von Chloridionen in wässrigen Proben. Entwickelt wurde diese Methode im 19. Jahrhundert und sie bleibt aufgrund ihrer Präzision und Zuverlässigkeit bis heute relevant. Durch den Einsatz einer Silbernitratlösung als Titrant kann der Chloridgehalt exakt quantifiziert werden.
Das Verfahren basiert auf der Fällung von Silberchlorid, das entsteht, wenn Silberionen auf Chloridionen treffen. Als Indikator wird häufig Kaliumchromat verwendet, welches bei Erreichen des Äquivalenzpunkts eine charakteristische Farbänderung hervorruft. Diese visuelle Veränderung ermöglicht eine genaue Erkennung des Endpunkts der Titration.
Die einfache Durchführung und die gute Reproduzierbarkeit machen die Mohrsche Titration zu einem weit verbreiteten Standard in der chemischen Analyse. Besonders in Bereichen wie der Umwelt- und Wasseranalytik spielt sie eine entscheidende Rolle, da hier oft genaue Messungen von Chloridkonzentrationen erforderlich sind.
Die Mohrsche Titration gehört zur anorganischen Chemie, da sie ein Verfahren zur Bestimmung von anorganischen Ionen, in diesem Fall von Chloridionen, in einer Lösung ist. Die Anorganische Chemie befasst sich mit der Chemie anorganischer Verbindungen, die nicht auf Kohlenstoff basieren, und umfasst unter anderem die Analytische Chemie, zu der die Mohrsche Titration als quantitatives Analyseverfahren gehört.
Das Wichtigste in Kürze
- Die Mohrsche Titration dient zur Bestimmung von Chloridionen in wässrigen Lösungen.
- Silbernitrat wird als Titrant verwendet, das mit Chloridionen zu Silberchlorid reagiert.
- Kaliumchromat dient als Indikator und zeigt den Äquivalenzpunkt durch Farbwechsel an.
- Die Methode ist präzise und weit verbreitet in der Umwelt- und Wasseranalytik.
- Berechnung der Chloridionenkonzentration erfolgt anhand des verbrauchten Volumens an Silbernitratlösung.
Die Mohrsche Titration ist ein analytisches Verfahren in der chemischen Analytik, das zur Bestimmung von Chloridionen in einer Lösung verwendet wird. Bei der Mohrschen Titration wird eine Silbernitratlösung als Titrationslösung verwendet, um die Chloridionen in der zu analysierenden Probe zu titrieren. Der Endpunkt der Titration wird durch die Bildung eines Silberchloridniederschlags angezeigt. Durch die Volumenmessung der Silbernitratlösung kann der Chloridgehalt in der Probe bestimmt werden. Die Mohrsche Titration ist ein wichtiges Verfahren in der quantitativen chemischen Analyse.
Beispiele
Hier sind Beispiele für Anwendungen der Mohrschen Titration:
- Bestimmung des Chloridgehalts in Salzlösungen
- Analyse von Speisesalz auf seinen Chloridgehalt
- Überwachung von Chloridionen in Schwimmbadwasser
- Quantitative Bestimmung von Chloridionen in Bodenproben
- Analyse von Salzen in der Lebensmittelindustrie auf ihren Chloridgehalt
- Messung des Salzgehalts in Meerwasser
- Überwachung von Chloridionen in Trinkwasserproben
- Analyse von Abwasserproben auf ihren Chloridgehalt
- Quantitative Bestimmung von Chloridionen in biologischen Proben
- Untersuchung von chloridhaltigen Produkten wie Reinigungsmitteln auf ihren Chloridgehalt
Prinzip der Mohrschen Titration
Die Mohrsche Titration ist ein klassisches analytisches Verfahren zur Bestimmung von Chloridionen in einer Lösung. Das Hauptprinzip basiert auf der Bildung eines schwerlöslichen Salzes, das durch eine Niederschlagsreaktion sichtbar gemacht wird.
Während der Titration wird eine Silbernitratlösung zu der zu untersuchenden Chloridlösung gegeben. Die Silberionen (Ag+) reagieren mit den Chloridionen (Cl–) zu Silberchlorid (AgCl), welches als weißer Niederschlag ausfällt. Diese Reaktion verläuft nach der Gleichung:
Ag+ + Cl– → AgCl↓.
Um den genauen Endpunkt der Titration deutlich sichtbar zu machen, wird Kaliumchromat (K2CrO4) als Indikator hinzugefügt. Sobald alle Chloridionen verbraucht sind, beginnen die überschüssigen Silberionen mit den Chromationen (CrO42-) zu reagieren und bilden rotes Silberchromat (Ag2CrO4). Dieser Farbumschlag markiert den sogenannten Äquivalenzpunkt. Der Grund für die Verwendung von Kaliumchromat liegt darin, dass es Ag2CrO4-Bildung erst bei höheren Ag+-Konzentrationen ermöglicht, was einen deutlichen, aber späten Farbumschlag zulässt.
Durch Kenntnis des Volumens der verbrauchten Silbernitratlösung lässt sich die Konzentration der Chloridionen berechnen. Dies bietet eine präzise Methode zur quantitativen Analyse von Lösungen mit Chloridgehalt.
„Die Mohrsche Titration ist eine der präzisesten Methoden zur Bestimmung von Chloridionen in wässrigen Lösungen.“ – Carl Friedrich Mohr
| Reagenzien | Geräte |
|---|---|
| Silbernitratlösung (AgNO3) | Bürette |
| Kaliumchromat (K2CrO4) | Erlenmeyerkolben |
| Chloridlösung (Probe) | Messzylinder |
| Destilliertes Wasser | Tropfpipette |
Reagenzien und Geräte für die Durchführung
Für die Durchführung der Mohrschen Titration benötigen Sie eine Reihe von Reagenzien und Geräten. Zuallererst wird eine Silbernitratlösung (AgNO3) als Titrant benötigt, da das Silberion mit den Chloridionen in einer klar definierten stöchiometrischen Reaktion reagiert. Zudem brauchen Sie eine Kaliumchromat-Lösung (K2CrO4) als Indikator, um den Äquivalenzpunkt der Titration zu visualisieren.
Ein weiteres essentielles Reagenz ist die Pufferlösung, die dazu dient, den pH-Wert der Lösung konstant zu halten, da dieser den Farbumschlag des Indikators beeinflussen kann. Distilliertes Wasser wird ebenfalls verwendet, um die Lösungen zu verdünnen oder Proben aufzulösen.
An Geräten wird ein Einstellkanister für die Silbernitrat-Lösung benötigt. Ein Messkolben dient zur Vorbereitung der Probe. Büretten sind erforderlich, um die Menge der Silbernitrat-Lösung präzise dosieren zu können.
Zusätzlich braucht man Erlenmeyerkolben, in denen die tatsächliche Reaktion und Titration durchgeführt werden. Ein magnetischer Rührer kann hilfreich sein, um die Lösungen gleichmäßig zu vermischen. Schließlich ist ein Halter für die Bürette nützlich, um eine stabile Handhabung und genaues Ablesen während des Titrierens zu gewährleisten.
Diese Reagenzien und Geräte sind miteinander kombiniert unverzichtbar, um exakte Ergebnisse bei der Bestimmung der Chlorid-Ionen-Konzentration durch die Mohrsche Titration zu erzielen.
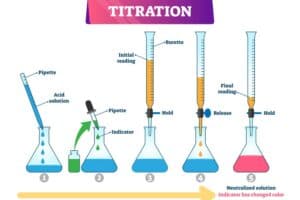
Ablauf der Titration schrittweise erklärt
Um die Mohrsche Titration durchzuführen, beginnt man mit der Vorbereitung einer Chloridionen-haltigen Probe. Zuerst füllt man einen Erlenmeyerkolben mit einer genauen Menge der zu untersuchenden Lösung. Diese muss exakt abgemessen werden, um präzise Ergebnisse zu erhalten.
Im nächsten Schritt wird eine passende Menge an Kaliumchromat-Lösung als Indikator hinzugefügt. Der gelb-orangene Farbton des Indikators ermöglicht die spätere sichtbare Reaktion beim Äquivalenzpunkt.
Nun wird eine Silbernitrat-Lösung (~0,1 N) in die Bürette eingefüllt. Die genaue Konzentration sollte bekannt sein, da sie für die Berechnung der Chloridionenkonzentration wichtig ist. Bei Beginn der Titration tropft man sorgfältig die Silbernitrat-Lösung in den Kolben, während ständig gerührt wird. Dabei reagiert das Silbernitrat mit den Chloridionen zur Bildung von unlöslichem Silberchlorid (AgCl), welches als weißer Niederschlag ausfällt.
Die Titration wird fortgesetzt bis eine neu entstehende rote Färbung durch Chromat-Ionen auftritt. Dieser Abrupte Farbwechsel deutet darauf hin, dass alle Chloridionen komplett ausgefällt und nun auch überschüssige Silberionen vorhanden sind, welche mit dem Chromat reagieren. Dies markiert den Äquivalenzpunkt.
Nachdem dieser Punkt erreicht ist, notiert man sich den Verbrauch an Silbernitratlösung. Anhand dieser Daten und unter Berücksichtigung der bekannten Konzentrationen kann dann die exakte Chloridionenkonzentration berechnet werden.
Dieser Ablauf zeigt den einfachen, aber effektiven Prozess der Mohrschen Titration zur Bestimmung von Chloridionen in Lösungen.
Chemische Reaktionen im Titrationsprozess
Die chemischen Reaktionen, die während der Mohrschen Titration ablaufen, sind präzise und deutlich. Zu Beginn fügt man der Probe eine gewisse Menge an Silbernitrat (AgNO₃) hinzu. Dieser Prozess führt zur Bildung eines weißen Niederschlags aus Silberchlorid (AgCl):
Ag⁺ + Cl⁻ → AgCl↓
Der Fällungsprozess ist praktisch vollständig und das Ausfallen von AgCl setzt sich solange fort, bis alle Chloridionen in Lösung verbraucht sind. Sobald dies erreicht ist, wird zusätzliches Silbernitrat in der Lösung verbleiben.
Um den Äquivalenzpunkt zu visualisieren, dient Kaliumchromat (K₂CrO₄) als Indikator. Erst nach vollständiger Fällung des Chlorids reagiert überschüssiges Silber mit dem Chromat:
2Ag⁺ + CrO₄²⁻ → Ag₂CrO₄↓
Diese Reaktion bildet einen roten Niederschlag aus Silberchromat. Der Farbumschlag signalisiert, dass der Äquivalenzpunkt erreicht wurde – also ein klarer Hinweis darauf, dass keine freien Chloridionen mehr vorhanden sind. Diese Farbreaktionen sind wesentliche Bestandteile der Mohrschen Titration und ermöglichen eine genaue Bestimmung.
Die einfache, aber effektive Chemie dieser Titrationsmethode steht im Kontrast zu komplexeren Verfahren wie der Ethylen-Polymerisation oder der Verwendung von Übergangsmetallkatalysatoren, welche bei Polymerketten-Wachstum entscheidend sind.
Visualisierung des Äquivalenzpunkts
Um den Äquivalenzpunkt in der Mohrschen Titration zu entdecken, wird Kaliumchromat als Indikator verwendet. Der Äquivalenzpunkt markiert den Moment, an dem alle Chloridionen mit Silberionen zur Ausfällung von Silberchlorid reagiert haben.
Zu Beginn der Titration bleibt die Lösung aufgrund des Vorhandenseins von gelben Chromationen relativ klar. Sobald sämtliche Chloridionen aus der Probe verbraucht sind, beginnen die Silberionen mit dem überschüssigen Kaliumchromat zu reagieren und es bildet sich langsam ein roter Niederschlag von Silberchromat.
Dieser Farbumschlag ist visuell gut erkennbar und kennzeichnet das Ende des Titrationsprozesses. Es sind nur minimalste Mengen überschüssiger Silberionen nötig, um den Farbwechsel eindeutig darzustellen.
Dank dieser Farbänderung erhalten Anwender eine klare Bestätigung über den erreichten Punkt der Reaktion. Dies erleichtert insbesondere auch Laien die Anwendung dieses Verfahrens.
Die Methode ist nicht nur effektiv, sondern auch verhältnismäßig einfach durchzuführen und bietet zuverlässige Ergebnisse bei der Bestimmung von Chloridionen-Konzentrationen.
| Chemisches Reagenz | Konzentration | Verwendung |
|---|---|---|
| Silbernitrat | 0,1 M | Titrant zur Bestimmung von Chloridionen |
| Kaliumchromat | sättige Lösung | Indikator zur Visualisierung des Äquivalenzpunkts |
| Chloridionen-haltige Probe | Variable | Analyte (zu untersuchende Lösung) |
Berechnung der Chloridionenkonzentration
Die Berechnung der Chloridionenkonzentration nach einer Mohrschen Titration erfolgt durch die präzise Ermittlung des Volumens der titrierten Lösung. Zunächst wird der Verbrauch der Silbernitrat-Lösung (AgNO3) bis zum Erreichen des Äquivalenzpunkts gemessen.
Nun berechnen Sie die Konzentration der Chloridionen (Cl⁻), indem Sie das verbrauchte Volumen an AgNO3 in die folgende Formel einsetzen:
C(Cl⁻) = (C(AgNO3) V(AgNO3)) / V_Probe
Hierbei steht C(Cl⁻) für die Konzentration der Chloridionen, C(AgNO3) für die Konzentration der Silbernitrat-Lösung und V(AgNO3) für das Volumen der hinzugefügten Silbernitrat-Lösung. Das Volumen der behandelten Probe ist als V_Probe bezeichnet.
Ein Beispiel soll dies verdeutlichen: Wenn 25 ml einer Wasserprobe mit einer Silbernitrat-Lösung von 0,1 mol/l titriert werden und dabei 10 ml verbraucht werden, ergibt sich folgende Rechnung:
C(Cl⁻) = (0,1 mol/l 10 ml) / 25 ml = 0,04 mol/l
Dies bedeutet, dass die Chloridionenkonzentration in der Wasserprobe 0,04 mol/l beträgt.
Diese Methode ist insbesondere in der Umwelt- und Wasseranalytik von großer Bedeutung, da sie genaue Aussagen über den Chloridgehalt in Proben ermöglicht.
Anwendung in der Umwelt- und Wasseranalytik
In der Umwelt- und Wasseranalytik spielt die Mohrsche Titration eine wichtige Rolle. Besonders bei der Bestimmung von Chloridionenkonzentrationen in Trinkwasser, Abwasser sowie natürlichen Gewässern ist dieses Verfahren weit verbreitet. Chloridionen können aus verschiedenen Quellen stammen, wie etwa der industriellen Emission oder dem Einsatz von Streusalz im Winter.
Durch die einfache und effektive Anwendung lässt sich die Mohrsche Titration problemlos in verschiedene Labors integrieren. Bei der Analyse wird oft auf standardisierte Methoden zurückgegriffen, um genaue und reproduzierbare Ergebnisse zu erhalten. Der Prozess beginnt mit der Probenahme, gefolgt von der Zugabe eines Indikators wie Kaliumchromat.
Wichtig ist auch der Beitrag zur Überwachung der Wasserqualität in Kläranlagen. Hier hilft die Mohrsche Titration, sicherzustellen, dass behandelte Abwässer den gesetzlichen Grenzwerten entsprechen. Dies trägt nicht nur zum Schutz der Umwelt bei, sondern gewährleistet auch die Einhaltung von Vorschriften.
Ein weiterer wichtiger Aspekt ist die Kontrolle der Qualität von Brunnen- und Oberflächenwasserquellen. Eine regelmäßige Überprüfung auf Chloridionen unterstützt dabei, Schadstoffeinträge frühzeitig zu erkennen und Gegenmaßnahmen zu ergreifen. Dadurch kann die Gesundheit von Ökosystemen und Menschen nachhaltig geschützt werden.
Zusätzlich zur Wasseranalyse findet die Mohrsche Titration Anwendung beim Monitoring von Bodenproben. Hier hilft sie, Salzanreicherungen festzustellen, die durch Bewässerungspraktiken oder landwirtschaftliche Maßnahmen entstehen können. Dies ermöglicht eine gezielte Steuerung von Düngemaßnahmen und trägt somit zur nachhaltigen Landwirtschaft bei.
Vorteile und Nachteile des Verfahrens
Die Mohrsche Titration bietet zahlreiche Vorteile und ist deswegen in der analytischen Chemie weit verbreitet. Ein wesentlicher Vorteil liegt in der einfachen Durchführung des Verfahrens. Spezielle Geräte oder besonders aufwendige Vorbereitungen sind nicht notwendig, was die Methode sowohl kostengünstig als auch schnell umsetzbar macht.
Darüber hinaus liefert die Mohrsche Titration sehr genaue Ergebnisse, insofern sie unter den richtigen Bedingungen durchgeführt wird. Die Reaktionsbedingungen müssen sorgfältig kontrolliert werden, da das Verfahren recht empfindlich gegenüber pH-Schwankungen ist.
Jedoch gibt es auch einige Nachteile, die beachten werden sollten. Einer der größten Nachteile ist die Empfindlichkeit gegenüber interferierenden Ionen. Speziell Sulfationen können die Genauigkeit der Messung beeinträchtigen, weshalb deren Anwesenheit vor der Titration überprüft und gegebenenfalls eliminiert werden muss. Auch ist das Verfahren nur für Lösungen geeignet, bei denen eine ausreichende Menge an Chloridionen vorhanden ist; niedrig konzentrierte Proben erzielen möglicherweise keine präzisen Ergebnisse.
Zudem erfordert die Visualisierung des Äquivalenzpunkts Erfahrung im Umgang mit Silberchromat, dem verwendeten Indikator. Eine Überdosierung des Titrationsmittels kann hier leicht zu Fehlinterpretationen führen, was wiederum die Zuverlässigkeit des gesamten Analyseverfahrens beeinflusst.
Insgesamt besticht die Mohrsche Titration durch ihre Einfachheit und Genauigkeit, verlangt jedoch ein gewisses Maß an chemischem Wissen und Kontrolle über die verschiedenen Parameter, um verlässliche Resultate zu liefern.