Was ist eine Redoxreaktion?
Redoxreaktionen spielen eine zentrale Rolle in der Chemie und beeinflussen zahlreiche Prozesse in unserem täglichen Leben. Diese chemischen Reaktionen umfassen sowohl die Oxidation als auch die Reduktion von Stoffen, wobei Elektronen übertragen werden. Solche Reaktionen sind nicht nur in industriellen Anwendungen wichtig, sondern auch in natürlichen biologischen Prozessen.
Ein klassisches Beispiel für eine Redoxreaktion findet sich bei Batterien und Akkumulatoren, wo Energie durch chemische Umwandlungen bereitgestellt wird. Auch im Bereich der Wasseraufbereitung und beim Korrosionsschutz von Metallen sind Redoxprozesse entscheidend. Das Verständnis dieser Reaktionen ist daher nicht nur für Chemiker essenziell, sondern hat auch direkte Auswirkungen auf viele technische und alltägliche Anwendungen.
Das Wichtigste in Kürze
- Redoxreaktionen sind grundlegende chemische Prozesse, die Elektronen zwischen Atomen oder Ionen übertragen.
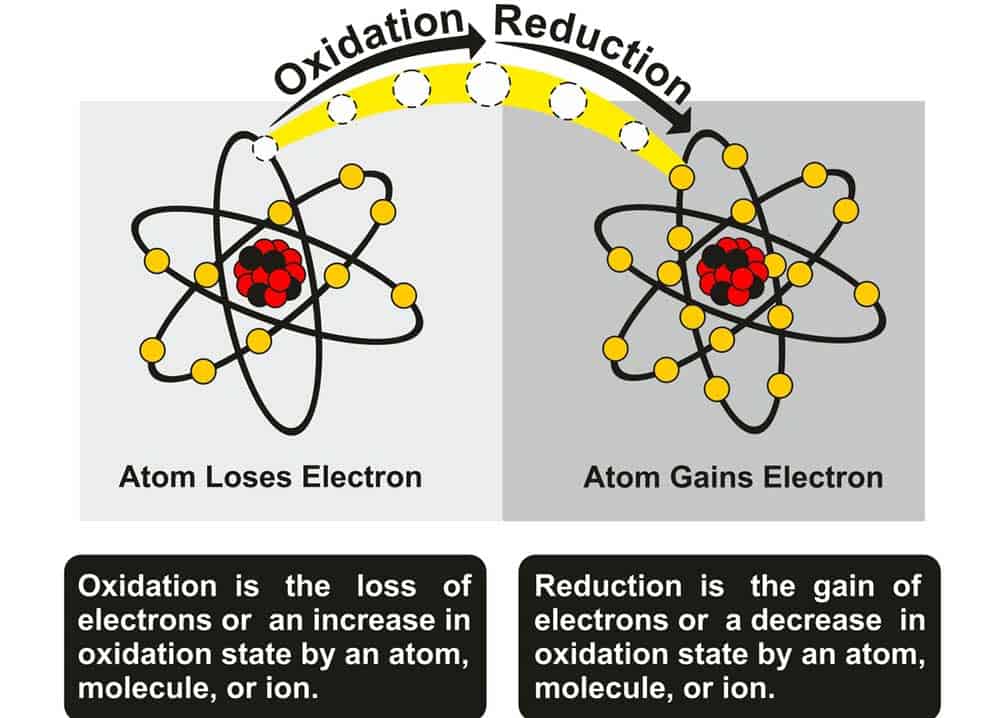
- Oxidation: Elektronenabgabe, Reduktion: Elektronenaufnahme, beides erfolgt gleichzeitig in Redoxreaktionen.
- Alltagsbeispiele: Rostbildung, Verbrennung, Bleichmittel, Bräunung von Lebensmitteln.
- Industrielle Anwendungen: Batterien, Metallgewinnung, Abwasseraufbereitung, Chlorproduktion.
- Redoxreaktionen sind auch entscheidend in der Biologie, z.B. Zellatmung und Photosynthese.
Eine Redoxreaktion ist eine chemische Reaktion, bei der Elektronenübertragungen zwischen Reaktionspartnern stattfinden. Dabei wird ein Element bzw. eine Verbindung oxidiert, indem es Elektronen verliert, während ein anderes Element bzw. eine Verbindung reduziert wird, indem es Elektronen aufnimmt. Redoxreaktionen sind auch als Oxidations-Reduktions-Reaktionen bekannt und spielen eine wichtige Rolle in vielen chemischen Prozessen, wie z.B. in Batterien, Korrosionsprozessen, der Atmung und vielen anderen biochemischen Reaktionen.
Beispiele
- Die Reaktion von Magnesium (Mg) mit Sauerstoff (O2) zur Bildung von Magnesiumoxid (MgO): Magnesium + Sauerstoff -> Magnesiumoxid 2Mg + O2 -> 2MgO
- Die Reaktion von Natrium (Na) mit Chlor (Cl2) zur Bildung von Natriumchlorid (NaCl): Natrium + Chlor -> Natriumchlorid 2Na + Cl2 -> 2NaCl
- Die Reaktion von Eisen(II)-Ionen (Fe^{2+}) mit Kaliumpermanganat (KMnO4) in saurer Lösung: Eisen(II)-Ionen + Kaliumpermanganat -> Eisen(III)-Ionen + Mangan(II)-Ionen 5Fe^{2+} + MnO_4^- + 8H^+ -> 5Fe^{3+} + Mn^{2+} + 4H_2O
- Die Reaktion von Wasserstoffperoxid (H2O2) mit Kaliumiodid (KI) in saurer Lösung: Wasserstoffperoxid + Kaliumiodid -> Wasser + Iod H2O2 + 2I^- + 2H^+ -> 2H2O + I2
- Die Reaktion von Kupfer(II)-Ionen (Cu^{2+}) mit Zink (Zn) zur Bildung von Kupfer und Zink(II)-Ionen: Kupfer(II)-Ionen + Zink -> Kupfer + Zink(II)-Ionen Zn + Cu^{2+} -> Zn^{2+} + Cu
- Die Reduktion von Eisen(III)-Ionen (Fe^{3+}) durch Zinn(II)-Ionen (Sn^{2+}): Eisen(III)-Ionen + Zinn(II)-Ionen -> Eisen(II)-Ionen + Zinn(IV)-Ionen 2Fe^{3+} + 3Sn^{2+} -> 2Fe^{2+} + 3Sn^{4+}
- Die Verbrennung von Methan (CH4) in Sauerstoff (O2) zur Bildung von Kohlendioxid (CO2) und Wasser (H2O): Methan + Sauerstoff -> Kohlendioxid + Wasser CH4 + 2O2 -> CO2 + 2H2O
- Die Elektrolyse von Natriumchlorid (NaCl) zur Bildung von Natrium (Na) und Chlorwasserstoff (HCl): Natriumchlorid + Wasser -> Natriumhydroxid + Wasserstoff + Chlor 2NaCl + 2H2O -> 2NaOH + H2 + Cl2
- Die Reaktion von Kaliumpermanganat (KMnO4) mit Kaliumiodid (KI) in saurer Lösung: Kaliumpermanganat + Kaliumiodid -> Kaliumsulfat + Iod + Mangansulfat + Wasser 5KI + 3H2SO4 + KMnO4 -> 5KHSO4 + 3I2 + MnSO4 + 2H2O
Ein weiteres Beispiel für eine Oxidationsreaktion ist die Reaktion zwischen Eisen und Salzsäure (HCl). Hier ist die chemische Formel für die Reaktion:
Fe + 2HCl -> FeCl2 + H2
In dieser Reaktion oxidieren Salzsäure und Eisen miteinander. Das Eisen gibt Elektronen ab, während das Chlor in der Salzsäure die Elektronen aufnimmt. Dadurch entsteht Eisen(II)-chlorid (FeCl2) und Wasserstoffgas (H2).
Die Reaktion zwischen Eisen und Salzsäure (HCl) ist keine Oxidationsreaktion, sondern eine Redoxreaktion. In dieser Reaktion gibt das Eisen Elektronen ab (Oxidation), während das Chlor in der Salzsäure die Elektronen aufnimmt (Reduktion). Daher handelt es sich um eine Redoxreaktion, die sowohl Oxidations- als auch Reduktionsprozesse umfasst.
Photosynthese: Während der Photosynthese in Pflanzen wird Kohlendioxid durch Sonnenlicht in Glukose umgewandelt, wobei Sauerstoff freigesetzt wird. Dies ist eine Redoxreaktion, bei der Kohlendioxid oxidiert und Wasser reduziert wird. Die Photosynthese ist ein Beispiel für eine Redoxreaktion, da sie sowohl eine Oxidation (von Kohlendioxid zu Glukose) als auch eine Reduktion (von Wasser zu Sauerstoff) umfasst. Daher kann die Photosynthese nicht ausschließlich als Oxidationsreaktion betrachtet werden, sondern als ein komplexer Prozess, der sowohl Oxidations- als auch Reduktionsprozesse beinhaltet. Während der Photosynthese in Pflanzen wird Kohlendioxid (CO2) durch Sonnenlicht in Glukose umgewandelt, wobei Sauerstoff (O2) freigesetzt wird. In diesem Prozess wird Kohlendioxid oxidiert. Während der Photosynthese in Pflanzen wird Kohlendioxid durch Sonnenlicht in Glukose umgewandelt, wobei Sauerstoff freigesetzt wird. Dies ist eine Redoxreaktion, bei der Kohlendioxid oxidiert und Wasser reduziert wird. In der Photosynthese handelt es sich um eine Redoxreaktion, da sowohl eine Oxidation (von Kohlendioxid zu Glukose) als auch eine Reduktion (von Wasser zu Sauerstoff) gleichzeitig stattfinden. Daher ist die Photosynthese eine Form von Redoxreaktion, die sowohl Oxidations- als auch Reduktionsprozesse umfasst. Während der Photosynthese wird Kohlendioxid oxidiert, was bedeutet, dass es Elektronen verliert und sein Oxidationszustand erhöht wird. Daher kann die Photosynthese als Beispiel für eine Oxidationsreaktion betrachtet werden.
Grundlagen der Redoxreaktionen verstehen
Redoxreaktionen sind chemische Reaktionen, bei denen Elektronen zwischen Atomen oder Ionen übertragen werden. Diese Prozesse spielen eine zentrale Rolle in vielen Bereichen der Chemie und Biologie. Um die Grundlagen zu verstehen, ist es wichtig, sich mit den Konzepten der Oxidation und Reduktion vertraut zu machen.Bei einer Oxidation verliert ein Atom bzw. Ion Elektronen, während bei einer Reduktion Elektronen aufgenommen werden. Dies führt oft zur Bildung neuer Verbindungen und kann unterschiedliche Produkte wie unlösliche Produkte hervorbringen. Ein klassisches Beispiel für eine solche Redoxreaktion ist die Reaktion zwischen Metallen und Säuren, bei der Wasserstoffgas freigesetzt wird.
Viele bekannte Substanzen entstehen durch Redoxreaktionen. Zum Beispiel entsteht Silberchlorid – ein wichtiger Bestandteil fotografischer Filme – aus der Reaktion von Silberionen mit Chloridionen in einer Doppeltauschreaktion. Weitere Beispiele umfassen Bariumcarbonat und deren bedeutende Verwendung in verschiedenen industriellen Anwendungen.
Ionenbindungen spielen ebenfalls eine entscheidende Rolle bei diesen Prozessen. Wenn bestimmte Ionen im Wasser gelöst sind, können sie miteinander reagieren und Niederschläge formen. Dies geschieht zum Beispiel bei der Bildung von schwer löslichen Salzen. Das sogenannte Löslichkeitsprodukt beschreibt das Gleichgewicht zwischen einem unlöslichen Salz und seinen in Wasser gelösten Ionen.
Zusammenfassend lässt sich sagen, dass das Verständnis der Grundlagen der Redoxreaktionen wesentlich dazu beiträgt, die daraus resultierenden chemischen Phänomene besser nachvollziehen zu können.
Chemische Reaktionen sind nicht einfach nur Worte auf Papier – sie sind lebendig und grundlegend für das Leben selbst. – Marie Curie
| Reaktionsbeispiel | Beschreibung |
|---|---|
| Silberionen + Chloridionen → Silberchlorid | Bildung des unlöslichen Produkts Silberchlorid, ein Fall von Niederschlag bei einer doppelten Austauschreaktion |
| Bariumionen + Carbonationen → Bariumcarbonat | Ein weiteres Beispiel für einen unlöslichen Niederschlag, typisch für Ionenreaktionen im Wasser |
| Metall + Säure → Wasserstoff + Salz | Reaktive Metalle reagieren mit Säuren unter Freisetzung von Wasserstoffgas und Bildung eines Salzes |
Redoxreaktionen haben mit Oxidation und Reduktion zu tun. Der Begriff „Redox“ stammt von den Wörtern „Reduktion“ und „Oxidation“. In einer Redoxreaktion findet eine Oxidation (Verlust von Elektronen) eines Reaktionspartners und eine Reduktion (Gewinn von Elektronen) eines anderen Reaktionspartners statt. Das Oxidationsmittel ist die Substanz, die Elektronen aufnimmt (reduziert wird), während das Reduktionsmittel die Substanz ist, die Elektronen abgibt (oxidiert wird). Die Gesamtbilanz der Elektronenübertragung in einer Redoxreaktion ist immer ausgeglichen, wodurch Energie freigesetzt oder aufgenommen wird.
Oxidation und Reduktion definieren
Oxidation und Reduktion sind zwei eng verknüpfte Begriffe, die den Kern der Redoxreaktionen ausmachen. Bei einer chemischen Reaktion handelt es sich stets um das Zusammenspiel dieser beiden Prozesse.
Oxidation beschreibt den Prozess, bei dem ein Atom oder Molekül Elektronen abgibt. Dies führt häufig dazu, dass das oxidierte Teilchen einen höheren Oxidationszustand erreicht. Ein klassisches Beispiel für eine Oxidation ist die Reaktion von Eisen mit Sauerstoff zu Eisenoxid, auch bekannt als Rost.
Auf der anderen Seite steht die Reduktion, bei der ein Atom oder Molekül Elektronen aufnimmt und somit seinen Oxidationszustand verringert. Eine übliche Darstellung des reduzierten Zustands findet sich in der Verwandlung von Kupferionen zu metallischem Kupfer.
Ein besonderes Augenmerk verdient der Begriff der „Redoxpaare“, die beide Komponenten – Reduktionsmittel und Oxidationsmittel – umfassen. In einem solchen Paar gibt das Reduktionsmittel Elektronen an das Oxidationsmittel ab.
In wässriger Lösung werden Ionen im Wasser durch ionische Wechselwirkungen stabilisiert und formen oft Niederschläge, wie zum Beispiel Silberchlorid oder Bariumcarbonat, wenn sie nicht mehr wasserlöslich sind. Diese bilden dann ein unlösliches Produkt, was bei der Salzbildung besonders relevant wird.
Solche Prozesse sind grundlegend für viele chemische Anwendungen, einschließlich der Ionenbindung und der Erstellung eines bestimmten Löslichkeitsprodukts bei doppelten Austauschreaktionen.
Beispiele für Redoxreaktionen im Alltag
Redoxreaktionen spielen eine wesentliche Rolle in unserem Alltag. Ein klassisches Beispiel ist das Anlaufen von Metallen, insbesondere Eisen. Wenn Eisen mit Sauerstoff in Gegenwart von Wasser reagiert, bildet sich Rost (Eisenoxid). Hierbei wird Eisen oxidiert, während Sauerstoff reduziert wird.
Ein weiteres alltägliches Beispiel ist die Verbrennung von Treibstoffen. Beim Verbrennen von Benzin im Auto findet eine Redoxreaktion statt, wobei der Kohlenstoff im Treibstoff zu Kohlendioxid oxidiert und der Sauerstoff in der Luft zu Wasser reduziert wird. Solche Reaktionen liefern die notwendige Energie für den Betrieb des Motors.
Auch in vielen Haushaltsreinigern sind Redoxreaktionen zu beobachten. Bleichmittel wie Chlorbleiche wirken durch Oxidation und zerstören Farbstoffe und Mikroorganismen.
In der Küche begegnet uns die Redoxchemie ebenfalls häufig. Das Bräunen von Lebensmitteln beim Kochen oder Backen ist eine Folge der Maillard-Reaktion, bei der Zucker und Aminosäuren reagieren. Außerdem fördert Sauerstoff das Nachreifen von Obst und Gemüse durch oxidative Prozesse.
Fotosynthese in Pflanzen und Zellatmung sind zwei grundlegend wichtige biologische Prozesse. Bei der Fotosynthese nutzen Pflanzen Sonnenlicht zur Produktion von Glukose und Sauerstoff aus Wasser und Kohlendioxid. Währenddessen werden Elektronen übertragen, was ein essentielles Merkmal von Redoxreaktionen ist.
Diese Beispiele zeigen, dass Redoxreaktionen vielfältig sind und unser tägliches Leben auf verschiedene Weisen beeinflussen.
Elektrochemische Zellen und Anwendungen
Elektrochemische Zellen sind faszinierende Geräte, die auf Redoxreaktionen basieren, um elektrische Energie zu erzeugen oder zu nutzen. Sie bestehen aus zwei Halbzellen, in denen jeweils eine Oxidations- und eine Reduktionsreaktion stattfinden. Diese beiden Prozesse sind durch einen elektrischen Leiter verbunden.
Primärzellen (nicht wiederaufladbare Batterien) und Sekundärzellen (wiederaufladbare Akkumulatoren) sind Beispiele für elektrochemische Zellen im Alltag. Während Primärzellen einmalig chemische Energie in elektrische Energie umwandeln und danach entsorgt werden, können Sekundärzellen mehrfach geladen und entladen werden.
Ein klassisches Beispiel einer elektrochemischen Zelle ist die Daniell-Zelle. Hierbei reagiert Kupfer mit Zink unter Bildung von Kupfersulfat und Zinksulfat. Diese Reaktion erzeugt eine Spannungsdifferenz, die zur Erzeugung elektrischer Energie genutzt wird.
In der Industrie spielen elektrochemische Zellen ebenfalls eine zentrale Rolle. Die Herstellung von Chlor und Natronlauge durch Elektrolyse ist ein typisches Beispiel. Auch in der Metallveredelung, wie beim Verchromen oder Verzinken, finden diese Zellen Anwendung.
Darüber hinaus haben elektrochemische Zellen Bedeutung bei der Speicherung erneuerbarer Energien. Lithium-Ionen-Akkus, die in modernen Elektronikgeräten und Elektrofahrzeugen verwendet werden, basieren auf komplexen Redoxreaktionen. Diese Technologie unterstützt die Mobilität und trägt zur Reduzierung von Emissionen bei.
Die Erforschung neuer Materialien und technischer Ansätze erweitern fortlaufend die Einsatzmöglichkeiten von elektrochemischen Zellen. So tragen sie aktiv zur Entwicklung nachhaltiger Energiespeicherlösungen bei.
Bedeutung der Redoxreaktionen in der Industrie
Redoxreaktionen spielen eine zentrale Rolle in vielen industriellen Prozessen und tragen erheblich zur modernen Technologie bei. Ein prominentes Beispiel ist die Metallgewinnung, insbesondere die Elektrolyse. Bei der Elektrolyse werden Metalle wie Aluminium oder Kupfer aus ihren Erzen extrahiert, was wesentlich effizienter ist als traditionelle Verfahren.
Ein weiteres wichtiges Anwendungsgebiet ist die Batterieproduktion. Batterien basieren auf elektrochemischen Zellen, welche durch Redoxreaktionen Energie speichern und wieder freisetzen. Dieses Prinzip ist nicht nur für Haushaltsgeräte unverzichtbar, sondern auch für den Betrieb von Elektrofahrzeugen und tragbaren Technologien.
In der chemischen Industrie dienen Redoxreaktionen zudem zur Herstellung zahlreicher Chemikalien. Die Produktion von Bleichmitteln, Düngemitteln und bestimmten Kunststoffen hängt maßgeblich von diesen Reaktionen ab. Hierbei werden gezielt Oxidations- und Reduktionsprozesse genutzt, um gewünschte Produkte zu synthetisieren.
Schließlich spielen Redoxmechanismen auch im Umweltschutz eine große Rolle. Verfahren wie die Abgasreinigung in Kraftwerken oder die Abwasseraufbereitung basieren oft auf Redoxreaktionen, um schädliche Substanzen zu neutralisieren oder zu entfernen. Dank dieser Prozesse können unter anderem Schwermetalle aus dem Wasser gefiltert und somit deren negative Auswirkungen auf die Umwelt reduziert werden.
All diese Anwendungen verdeutlichen, wie fundamental Redoxreaktionen für verschiedenste Bereiche sind und welch wichtige Funktion sie erfüllen.
| Industrieprozess | Redoxbeteiligung | Nutzen |
|---|---|---|
| Batterieproduktion | Elektronentransfer bei elektrochemischen Zellen | Speichern und Bereitstellen von Energie |
| Metallveredelung | Oxidation und Reduktion von Oberflächen | Korrosionsschutz und dekorative Beschichtung |
| Wasseraufbereitung | Reduktion von Schadstoffen | Sauberes Trinkwasser |
Redoxreaktionen in biologischen Prozessen
Redoxreaktionen spielen eine zentrale Rolle in zahlreichen biologischen Prozessen. Eine der bekanntesten Redoxreaktionen ist die Zellatmung, bei der Glukose zu Kohlendioxid und Wasser oxidiert wird, während Sauerstoff reduziert wird. Diese vielfach ablaufende Oxidation und Reduktion ermöglicht es Zellen, Energie in Form von ATP zu gewinnen.
Ein weiteres bemerkenswertes Beispiel ist die Photosynthese in Pflanzen. Hierbei wird Wasser oxidiert und Kohlenstoffdioxid reduziert, was zur Bildung von Glukose und Sauerstoff führt. Diese Reaktion ist essenziell für das Leben auf der Erde, da sie nicht nur als primäre Energiequelle für Pflanzen dient, sondern auch den benötigten Sauerstoff produziert.
Enzyme wie Cytochrom c spielen ebenfalls wichtige Rollen bei biologischen Redoxreaktionen. Sie katalysieren Elektronentransportprozesse in der Atmungskette, wodurch effizient Energie gewonnen wird.
Die Fähigkeit bestimmter Mikroorganismen, verschiedene Substanzen durch Redoxreaktionen abzubauen oder umzuwandeln, wird für biotechnologische Anwendungen genutzt. Solche Organismen können etwa Schadstoffe in der Umwelt abbauen oder Metalle aus Ionen im Wasser extrahieren.
Insgesamt sind Redoxreaktionen fundamentale Mechanismen, die biologische Systeme in einem Gleichgewicht halten und ermöglichen, dass Lebewesen wachsen, sich vermehren und auf externe Veränderungen reagieren.
Sicherheitsmaßnahmen bei Redoxreaktionen
Bei der Durchführung von Redoxreaktionen ist es wichtig, angemessene Sicherheitsmaßnahmen zu beachten, um Unfälle und Verletzungen zu vermeiden. Zunächst sollten stets geeignete Schutzausrüstungen wie Laborkittel, Handschuhe und Schutzbrillen getragen werden. Diese schützen vor chemischen Spritzern und Dämpfen, die bei solchen Reaktionen auftreten können.
Um sicherzustellen, dass Materialien wie ein unlösliches Produkt oder eine Ionenbindung korrekt gehandhabt werden, muss der Arbeitsplatz sauber und ordentlich gehalten werden. Das bedeutet auch, dass nur notwendige Chemikalien und Werkzeuge auf dem Arbeitstisch stehen dürfen, um Verwechslungen und unbeabsichtigte Reaktionen zu verhindern.
Es ist ebenfalls ratsam, sich mit den spezifischen Risiken der verwendeten Chemikalien vertraut zu machen. Einige Stoffe können beispielsweise explosive Wasserstoffentwicklungen hervorrufen, während andere brandfördernd wirken. Eine gründliche Kenntnis des Sicherheitsdatenblatts (SDS) für jede Chemikalie ist daher unerlässlich.
Darüber hinaus sollte in sicheren und ausreichend belüfteten Räumlichkeiten gearbeitet werden. Viele Redoxreaktionen setzen Gase frei, die schädlich sein können. Eine gute Lüftung, idealerweise mit einem Dunstabzug, kann das Risiko einer gefährlichen Exposition minimieren.
Schließlich ist es wichtig, im Notfall richtig handeln zu können: Ob Feuerlöscher, Augenspülstationen oder Erste-Hilfe-Kästen – sie müssen jederzeit griffbereit und funktionsfähig sein. Die Kenntnis der Standorte und der Handhabung dieser Geräte rettet im Ernstfall Leben und reduziert die Auswirkungen von Unfällen erheblich.
Zukünftige Entwicklungen in der Redoxchemie
In den kommenden Jahren erwarten Experten bedeutende Fortschritte in der Redoxchemie. Ein zentrales Forschungsgebiet ist die Entwicklung von effizienteren Batterien und Energiespeichersystemen, um den steigenden Bedarf an nachhaltiger Energie zu decken.
Eine vielversprechende Technologie sind Redox-Flow-Batterien, die durch ihre Flexibilität und Skalierbarkeit überzeugen. Diese Batterien könnten eine entscheidende Rolle spielen, insbesondere für die Stabilisierung von Stromnetzen mit hohem Anteil erneuerbarer Energien.
Ein weiteres spannendes Feld ist die Katalyse. Neue Katalysatoren könnten chemische Prozesse nicht nur beschleunigen, sondern auch umweltfreundlicher gestalten. Dabei steht insbesondere die Nutzung von Wasserstoff im Fokus, da Wasserstoff als sauberer Energieträger gilt.
Auch in der Medizin finden zukünftige Entwicklungen in der Redoxchemie Anwendung. Neue Ansätze zur gezielten Oxidation oder Reduktion spezifischer Biomoleküle könnten innovative Therapieformen gegen verschiedene Krankheiten ermöglichen.
Zusätzlich wird an robusteren Materialien gearbeitet, die in aggressiven Umgebungen stabil bleiben. Solche Materialien sind besonders für industrielle Anwendungen interessant, in denen extremere Bedingungen herrschen.
Diese fortschreitenden Forschungsergebnisse versprechen, viele Lebensbereiche nachhaltig zu beeinflussen und bieten spannende Perspektiven für Technologien der Zukunft.