Was ist eine Additionsreaktion?
Die Additionsreaktion ist eine chemische Reaktion, bei der zwei oder mehr Moleküle direkt miteinander verbunden werden. Es gibt verschiedene Typen von Additionsreaktionen, darunter elektrophile, nucleophile und radikalische Additionen. Bei einer elektrophilen Addition greift eine Region hoher Elektronendichte ein Elektrophil an, während bei der nucleophilen Addition ein Nucleophil ein Elektrophil angreift.
Ein Vorteil dieser Reaktionen ist, dass dabei typischerweise nur wenige Nebenprodukte entstehen. Dies macht sie besonders attraktiv für industrielle Anwendungen wie die Herstellung von Kunststoffen und Pharmazeutika. Die Reaktionsbedingungen können jedoch stark variieren und umfassen Faktoren wie Temperatur, Druck und den Einsatz von Katalysatoren.
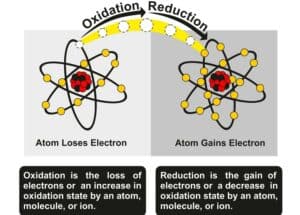
Die Handhabung reaktiver Chemikalien erfordert besondere Sicherheitsvorkehrungen, um Unfälle zu vermeiden. In der Redoxchemie kommt es häufig zu Selbstoxidation oder Selbstreduzierung, wobei oft mittlere Oxidationsstufen erreicht werden. Ein Beispiel hierfür ist Chlor in Wasser, das durch Synproportionierung zu unterschiedlichen Produkten führen kann. Dabei ändern sich die Oxidationszahlen und es können komplexe Verbindungen wie bei der Elektrodengrundwasserbildung entstehen.
Das Wichtigste in Kürze
- Additionsreaktionen verbinden Moleküle direkt ohne Atome freizusetzen.
- Es gibt elektrophile, nucleophile und radikalische Additionen.
- Geringe Nebenprodukte machen diese Reaktion industriell attraktiv.
- Schlüsselfaktoren: Temperatur, Druck und Katalysatoren.
- Sicherheitsmaßnahmen sind entscheidend für den Umgang mit reaktiven Chemikalien.
Eine Additionsreaktion ist eine chemische Reaktion, bei der zwei oder mehr Moleküle miteinander reagieren und sich zu einem einzigen Produkt addieren, ohne dass ein Molekül abgespalten wird. In Additionsreaktionen werden Doppel- oder Dreifachbindungen zwischen Atomen aufgebrochen, um neue Bindungen zu bilden und somit die Anzahl der Atome im Produkt zu erhöhen.
Beispiele
Die folgenden Beispiele zeigen, wie in Additionsreaktionen Moleküle an Doppelbindungen addiert werden, um neue Verbindungen zu bilden.
- Ein Beispiel für eine Additionsreaktion ist die Reaktion von Wasserstoff (H2) mit Sauerstoff (O2) zur Bildung von Wasser (H2O). Diese Reaktion ist ein klassisches Beispiel für eine Additionsreaktion, bei der die beiden Gase miteinander reagieren und sich zu einem Produkt addieren, ohne dass ein Molekül abgespalten wird.
- Hydrierung von Alkenen: Bei der Hydrierung von Alkenen werden Wasserstoffmoleküle an die Doppelbindung addiert, wodurch Alkane gebildet werden. Ein Beispiel ist die Hydrierung von Ethylen zu Ethan:
Hydrierung von Alkenen: H2C=CH2 + H2 -> H3C-CH3
- Addition von Brom an Alkene: Bei der Addition von Brom an ein Alken entsteht ein Diol. Ein Beispiel ist die Addition von Bromwasser an Propen:
Addition von Brom an Alkene: CH3CH=CH2 + Br2 -> CH3CHBr-CH2Br
Die angegebenen Beispiele für die Hydrierung von Alkenen und die Addition von Brom an Alkene sind korrekte Beispiele für Additionsreaktionen. In der Hydrierung von Alkenen wird Wasserstoff an die Doppelbindung addiert, um Alkane zu bilden. Bei der Addition von Brom an Alkene wird Brom an die Doppelbindung addiert, um ein Diol zu bilden.
- Polymerisation von Ethylen zu Polyethylen: Bei der Polymerisation von Ethylen entstehen lange Ketten von Polyethylen, indem Ethylenmoleküle aneinander addiert werden, um das Polymer Polyethylen zu bilden.
Polymerisation von Ethylen zu Polyethylen: (n) C2H4 -> (-CH2-CH2-)n - Addition von Wasser an Alkene zur Bildung von Alkoholen: Bei der Hydratation von Alkenen wird Wasser an die Doppelbindung addiert, um Alkohole zu bilden. Ein Beispiel ist die Addition von Wasser an Propen, um Isopropanol zu bilden:
Addition von Wasser an Alkene zur Bildung von Alkoholen: CH3CH=CH2 + H2O -> CH3CHOHCH3
Definition der Additionsreaktion: direkte Stoffbindung
Eine Additionsreaktion beschreibt den Prozess, bei dem zwei oder mehr Moleküle zu einem einzigen Produkt reagieren. Bei dieser Reaktion werden keine Atome freigesetzt oder entfernt; vielmehr erfolgt eine direkte Stoffbindung zwischen den reagierenden Verbindungen. Diese direkte Verbindung führt dazu, dass ein neues, komplexeres Molekül gebildet wird.
Ein Beispiel für eine typische Additionsreaktion ist die Addition von Wasserstoff (H2) an ein Alken wie Ethylen, um Ethan zu erzeugen. Hierbei bindet sich das Wasserstoffmolekül an die Kohlenstoffatome der Doppelbindung im Ethylen und wandelt es in eine Einfachbindung um. Dies illustriert eindrücklich, wie bestimmte Reaktionsbedingungen wie Katalysatoren und Temperatur von wesentlicher Bedeutung sein können, um diese Art der chemischen Reaktionen effizient durchzuführen.
Die direkt resultierenden Produkte sind oftmals stabiler als ihre Ausgangsmaterialien, was hauptsächlich auf die Bildung von stabileren Bindungen zurückgeführt werden kann. In diesem Zusammenhang ist es wichtig, Begriffe wie Synproportionierung und Komplexbildung zu verstehen, da sie häufig im Rahmen von Additionsreaktionen vorkommen. Betrachtet man beispielsweise die Wechselwirkung von Chlor in Wasser, so können verschiedene Oxidationszahlen ändern, was selbst zu Selbstoxidation und Selbstreduzierung führen kann – Prozesse, die eng mit der Redoxchemie verbunden sind.
Unedle Metalle können auch eine wichtige Rolle in Additionsreaktionen spielen, insbesondere aufgrund ihrer Fähigkeit zur Elektronendichte-Punkt-Attacke. Nicht selten betragen die entstehenden Produkte mittlere Oxidationsstufen. Solche Prinzipien finden breite Anwendungen nicht nur in der synthetischen Chemie, sondern auch in Bereichen wie Elektrodengrundwasserbehandlung. Die speziellen Reaktionsmechanismen hängen stark von den beteiligten Molekülen und der jeweiligen chemischen Umgebung ab.
Eine der größten Freuden der chemischen Synthese liegt in der Eleganz und Einfachheit gut geplanter Reaktionen. – Robert Burns Woodward
| Parameter | Beschreibung |
|---|---|
| Definition der Additionsreaktion | Direkte Stoffbindung zwischen zwei oder mehr Molekülen |
| Typen der Additionsreaktionen | Elektrophil, nucleophil, radikalisch |
| Mechanismus der elektrophilen Addition | Elektronendichte-Punkt-Attacke durch ein Elektrophil |
| Mechanismus der nucleophilen Addition | Nucleophiler Angriff auf ein Elektrophil |
| Typische Beiprodukte | Keine bis wenige Nebenprodukte |
| Industrielle Anwendung | Kunststoffe, Pharmazeutika |
| Reaktionsbedingungen | Temperatur, Druck, Katalysatoren |
| Sicherheitsaspekte | Handhabung reaktiver Chemikalien |
Typen der Additionsreaktionen: elektrophil, nucleophil, radikalisch
Es gibt verschiedene Typen von Additionsreaktionen, zu denen die elektrophile, nucleophile und radikalische Addition gehören. Diese Kategorien beschreiben, auf welche Weise neue Bindungen in einer chemischen Reaktion gebildet werden.
Bei der elektrophilen Addition greift ein Elektronenpaar an eine ungesättigte Verbindung wie ein Alken oder Alkin an. Das Schlüsselmerkmal dieser Reaktion ist, dass ein Elektrophil – ein Molekül, das Elektronenpaare aufnehmen kann – auf eine Region mit hoher Elektronendichte trifft. Dadurch wird die Doppel- oder Dreifachbindung aufgebrochen und es bilden sich zwei neue kovalente Bindungen.
Die nucleophile Addition funktioniert hingegen durch den Angriff eines Nucleophils auf ein Elektrophil. Ein Nucleophil ist dabei ein Teilchen oder Molekül, das reich an Elektronenpaaren ist und diese zur Verfügung stellt, um eine Bindung zu einem Zentrum niedriger Elektronendichte zu bilden. Dies erfolgt typischerweise bei Verbindungen mit polaren Mehrfachbindungen, wie Aldehyden oder Ketonen.
Radikalische Additionsreaktionen geschehen unter gleichzeitiger Anwesenheit ungepaarter Elektronen, sogenannter Radikale. Diese sind hochreaktiv und können sehr schnell neue Bindungen bilden. Häufig entstehen hierbei stabile Zwischenprodukte, bevor letztendlich das Endprodukt gebildet wird.
Diese drei Mechanismen zeigen eindrucksvoll, wie Vielfältig und spezifisch chemische Bindungen geformt werden können und ermöglichen zahlreiche Anwendungen in verschiedenen Bereichen.
Mechanismus der elektrophilen Addition: Elektronendichte-Punkt-Attacke
Im Mechanismus der elektrophilen Addition spielt die Elektronendichte eine entscheidende Rolle. Zunächst greift ein Elektrophil, welches selbst eine Elektronenlücke aufweist, die Doppelbindung eines ungesättigten Moleküls an. Diese Angriffsstelle kann als Punkt hoher Elektronendichte betrachtet werden.
Es kommt zur Bildung eines Zwischenprodukts, des sogenannten pi-Komplexes, wobei das Elektrophil und das ungesättigte Molekül vorübergehend ein gemeinsames Elektronenpaar teilen. Dieser Prozess verleiht dem pi-Komplex einen instabilen Charakter, was zur Folge hat, dass er sich rasch weiter über molekulare Umlagerungen entwickelt.
Ein bekanntes Beispiel für diese Art von Reaktion ist die Addition von Chlor in Wasser zu Alkenen. Das Chlor fungiert dabei als Elektrophil und bindet bevorzugt an den Punkt höchster Elektronendichte. Die Anwesenheit von unedlen Metallen wie Platin oder Palladium kann diesen Vorgang katalysieren und beschleunigen.
Während des Reaktionsverlaufs kommt es zu einer Änderung der Oxidationszahlen der beteiligten Atome. Häufig führen elektrophile Additionen zu stabileren Endprodukten mit geringerer Gesamtenergie im Vergleich zum Ausgangszustand.
In speziellen Fällen können zusätzliche Schritte wie Selbstoxidation oder Selbstreduzierung Einfluss nehmen, wenn die mittlere Oxidationsstufe des Produkts dies begünstigt. Bei radikalischen Prozessen sind auch Synproportionierungsreaktionen denkbar, bei denen zwei unterschiedliche Spezies derselben Verbindung zusammenwirken, um das finale Produkt zu bilden.
Mechanismus der nucleophilen Addition: Elektrophil-Angriff durch nucleophil
Nucleophile Addition an ein Molekül erfolgt durch den Angriff eines nucleophilen Reaktanten auf ein elektrophiles Zentrum innerhalb des Zielmoleküls. Diese Art der chemischen Reaktion ist besonders bedeutsam in der organischen Chemie und spielt eine Schlüsselrolle bei der Synthese von verschiedenen chemischen Verbindungen.
Der Mechanismus setzt voraus, dass das Molekül ein elektrophiles C-Atom besitzt. Dies kann beispielsweise durch Elektronen ziehende Gruppen wie Carbonylgruppen (C=O) realisiert werden. Durch die Anwesenheit dieser Gruppen wird das Kohlenstoffatom partiell positiv geladen und somit anfällig für einen Angriff von Nucleophilen.
Ein typischer Ablauf beginnt damit, dass der nucleophile Reaktant – häufig ein Anion oder ein Molekül mit einem freien Elektronenpaar – das elektrophile Zentrum attackiert. Es bildet sich eine neue kovalente Bindung zwischen dem nucleophilen Atom und dem Kohlenstoffatom des Zielmoleküls. Dadurch wird die Doppelbindung, beispielsweise der Carbonylgruppe, aufgebrochen und eine Zwischenstufe erzeugt.
In nachfolgenden Schritten können weitere Umwandlungen stattfinden, um das endgültige Produkt zu erhalten. Diese Prozesse bedürfen oft spezifischer Bedingungen hinsichtlich Temperatur, Druck und dem Einsatz geeigneter Katalysatoren, um die gewünschten Produkte effizient zu synthetisieren.
Eines der bekanntesten Beispiele für nucleophile Additionen ist die Reaktion eines Aldehyds mit einem Alkohol zur Bildung eines Halbacetals. In industriellen Anwendungen findet man diesen Mechanismus häufig bei der Herstellung von Pharmazeutika sowie Kunststoffen, wo chemische Präzision und Effizienz der Reaktionen essentiell sind.
Typische Beiprodukte: keiner bis wenige Nebenprodukte
Typische Beiprodukte von Additionsreaktionen variieren stark, je nach welchem Mechanismus und welchen Ausgangsstoffen man betrachtet. In vielen Fällen sind diese Reaktionen jedoch dafür bekannt, keiner bis wenige Nebenprodukte zu erzeugen. Dies liegt daran, dass Additionsreaktionen durch die direkte Anlagerung von Atomen oder Molekülen an eine bestehende Struktur gekennzeichnet sind.
In einer elektrophilen Addition zum Beispiel greifen elektronenliebende (elektrophile) Teilchen Doppelbindungen in Kohlenwasserstoffen wie Alkenen an. Dabei entsteht das Produkt ohne die Bildung vieler unerwünschter Nebenprodukte. Diese Effizienz ist besonders vorteilhaft für industrielle Anwendungen, da es weniger Nachbearbeitung und Reinigung erfordert.
Ein weiterer Vorteil der geringen Nebenproduktbildung zeigt sich in der chemischen Synthese von Pharmazeutika. Hier ist es entscheidend, hochreine Produkte zu erhalten, weshalb die geringe Anzahl an Nebenprodukten diesen Reaktionstyp so attraktiv macht.
Nucleophile Additionen bieten ebenfalls Vorteile in Bezug auf Reinheit und Ausbeute. Da bei diesen Reaktionen nucleophile Teilchen positiv geladene Zentren angreifen, können sie auch mit minimaler Bildung von Nebenprodukten ablaufen.
Dies alles führt dazu, dass Additionsreaktionen oft als sehr selektiv und effizient angesehen werden. Ob nun in der Produktion von Kunststoffen oder in der Synthese spezieller Chemikalien – die Kontrolle über den Reaktionsverlauf und die Reduktion von Nebenprodukten machen diese Reaktionen äußerst wertvoll.
| Reaktionstyp | Mechanismus | Beispiel |
|---|---|---|
| Elektrophile Addition | Elektronendichte-Punkt-Attacke | Chlorierung von Alkenen |
| Nucleophile Addition | Nucleophiler Angriff | Aldehyde mit Alkohol |
| Radikalische Addition | Angriff durch Radikale | Polymerisation von Ethen |
Industrielle Anwendung: Kunststoffe, Pharmazeutika
Additionsreaktionen spielen eine wichtige Rolle in der industriellen Fertigung, insbesondere bei der Herstellung von Kunststoffen und Pharmazeutika. Diese chemischen Reaktionen ermöglichen es, Monomere zu Polymeren umzuwandeln, die als Grundbausteine für viele Kunststoffe dienen. Typische Beispiele sind Polyethylen, Polypropylen und PVC, die durch spezifische Additionsverfahren produziert werden.
In der Pharmaindustrie sind Additionsreaktionen ebenfalls unverzichtbar. Sie erlauben es, komplexe Moleküle effizient und mit hoher Präzision zu synthetisieren. Häufig wird dabei auf katalytische Systeme gesetzt, um die erforderlichen Bedingungen zu schaffen. Dabei können sowohl elektrophile als auch nucleophile Additionsreaktionen zum Einsatz kommen, abhängig von der chemischen Struktur des Zielmoleküls.
Ein Vorteil dieser Reaktionen ist, dass sie meist sehr selektiv ablaufen, wodurch Nebenprodukte minimal bleiben. Dies trägt zur Reinheit und zur hohen Ausbeute des Endprodukts bei – ein kritischer Aspekt sowohl in der Kunststoff- als auch in der Pharmaherstellung.
Die richtige Auswahl der Reaktionsbedingungen wie Temperatur, Druck und Katalysatoren kann den Ablauf und das Ergebnis erheblich beeinflussen. Besondere Vorsicht ist dabei geboten, da einige der verwendeten Ausgangschemikalien recht reaktiv und potenziell gefährlich sein können.
Zusammenfassend lässt sich sagen, dass Additionsreaktionen zentrale Bausteine in der modernen Chemie darstellen, sowohl für die Kunststoffproduktion als auch für die Synthese wichtiger pharmazeutischer Wirkstoffe.
Reaktionsbedingungen: Temperatur, Druck, Katalysatoren
Reaktionsbedingungen wie Temperatur, Druck und Katalysatoren spielen eine entscheidende Rolle bei der Durchführung von Additionsreaktionen. Eine präzise Einstellung dieser Parameter kann den Verlauf und die Ausbeute der Reaktion maßgeblich beeinflussen.
Die optimale Temperatur für eine Additionsreaktion hängt stark von den beteiligten Reaktanten und dem verwendeten Mechanismus ab. Höhere Temperaturen können die Reaktionsgeschwindigkeit erhöhen, während niedrigere Temperaturen selektivere Produkte begünstigen können.
Auch der Druck ist ein wichtiger Faktor. Bei bestimmten Additionsreaktionen kann erhöhter Druck dazu beitragen, dass die Moleküle effizienter miteinander reagieren. Dies ist besonders relevant bei gasförmigen Reaktanten, da ein höherer Druck die Kontaktfläche zwischen den Reaktanten vergrößert und somit die Wahrscheinlichkeit einer erfolgreichen Reaktion erhöht.
Katalysatoren sind häufig unverzichtbar, um die Effizienz einer Additionsreaktion zu steigern. Ein geeigneter Katalysator kann die Aktivierungsenergie der Reaktion senken und somit eine schnellere und energiesparendere Durchführung ermöglichen.
In industriellen Anwendungen wird die Wahl des richtigen Katalysators oft durch Faktoren wie Kosten, Verfügbarkeit und spezifische Anforderungen der gewünschten Endprodukte bestimmt.
Zusammenfassend lässt sich sagen, dass die sorgfältige Kontrolle der Reaktionsbedingungen ausschlaggebend für das Gelingen einer Additionsreaktion ist. Angepasste Temperatur- und Druckbedingungen sowie der Einsatz geeigneter Katalysatoren können die Ausbeute und Reinheit der Produkte signifikant verbessern.
Sicherheitsaspekte: Handhabung reaktiver Chemikalien
Die Handhabung reaktiver Chemikalien erfordert besondere Aufmerksamkeit und Sorgfalt. Diese Verbindungen können stark reagieren, wenn sie nicht sachgemäß gelagert oder verwendet werden. Um Gefahren zu minimieren, sind mehrere Sicherheitsmaßnahmen zwingend notwendig.
Schutzausrüstung ist unerlässlich. Dies umfasst Schutzbrillen, Handschuhe, Gesichtsschilde und geeignete Kleidung, um direkten Kontakt mit den Chemikalien zu vermeiden. Auch Atemschutzmasken könnten erforderlich sein, wenn die Gefahr besteht, dass flüchtige Dämpfe oder Gase entstehen.
Der Umgang mit Chemikalien sollte in gut belüfteten Bereichen erfolgen. Abzüge oder spezielle Arbeitstische mit integrierten Lüftungssystemen helfen dabei, schädliche Dämpfe und Gase abzuleiten. Zudem sollten Feuerlöscher und Notduschen in unmittelbarer Nähe zur Verfügung stehen, um im Falle eines Unfalls schnell reagieren zu können.
Reaktive Chemikalien müssen fachgerecht gelagert werden. Dies bedeutet, sie getrennt von anderen reaktiven Stoffen zu lagern, um ungewollte Reaktionen zu verhindern. Spezielle Lagerbehälter, welche gegen Auslaufen gesichert sind, tragen zusätzlich zur Sicherheit bei.
Regelmäßige Schulungen für das Personal sind ebenfalls entscheidend. Sie gewährleisten, dass alle Personen, die mit diesen Chemikalien arbeiten, über die notwendigen Sicherheitsmaßnahmen informiert und auf dem neuesten Stand der Vorschriften sind.
Durch diese Maßnahmen lässt sich das Risiko, das von der Handhabung reaktiver Chemikalien ausgeht, erheblich reduzieren. Es ist von höchster Wichtigkeit, dass jeder Schritt sorgfältig geplant und ausgeführt wird, um die Gesundheit aller Beteiligten zu schützen.