Eine Oxidationsreaktion ist eine grundlegende chemische Reaktion, bei der Elektronenübertragungen zwischen Atomen oder Molekülen stattfinden. Diese Prozesse sind ein wesentlicher Teil vieler chemischer und biologischer Vorgänge. Bei einer Oxidation gibt ein Elektronendonator Elektronen ab, während ein Elektronenakzeptor diese aufnimmt, was oft zu einer Sauerstoffaufnahme führt.
Die Oxidationsreaktion wird meist zusammen mit dem Begriff der Reduktion verwendet; gemeinsam bilden sie eine Redoxreaktion. Hierbei spielt das Oxidationsmittel die Rolle des Elektronenakzeptors, während das Reduktionsmittel als Elektronendonator fungiert. Ein Beispiel für alltägliche Oxidationsprozesse bietet die Verbrennungsreaktion, die Energie freisetzt und in verschiedenen industriellen Anwendungen genutzt wird.
Energieumwandlung in biologischen Systemen wie der Zellatmung ist ebenfalls ein Beispiel für eine Oxidationsreaktion. Bei diesen Prozessen beeinflussen Faktoren wie der Oxidationszustand und die Oxidationszahl der beteiligten Atome das Resultat und den Verlauf der Reaktion. Moderne Forschungen konzentrieren sich auf die Verbesserung von Verfahren zur Verhinderung unerwünschter Oxidationen, die negative Auswirkungen haben können.
Entwicklungen in der Elektrochemie eröffnen neue Ansätze zur Steuerung von elektrochemischen Zellen und Reaktionen. Diese Erkenntnisse sind nicht nur in der Chemie selbst, sondern auch in Bereichen wie der Energietechnik und Umweltwissenschaften von großer Bedeutung.
Das Wichtigste in Kürze
- Oxidationsreaktionen: Grundlegende chemische Prozesse, bei denen Elektronen abgegeben werden.
- Redoxreaktionen: Enge Verbindung von Oxidation und Reduktion, entscheidend für Energieumwandlung.
- Elektrochemie: Erforschung von Methoden zur Steuerung und Nutzung von Oxidationsprozessen.
- Industrielle Anwendungen: Petrochemie, Metallherstellung, Wasseraufbereitung und Katalyse.
- Schutzmaßnahmen: Antioxidantien und Beschichtungen verhindern unerwünschte Oxidation und Rost.
Eine Oxidationsreaktion ist ein chemischer Prozess, bei dem ein chemischer Stoff Elektronen verliert oder seinen Oxidationszustand erhöht. In einer Oxidationsreaktion tritt häufig eine Reaktion mit Sauerstoff auf, aber nicht immer. Oxidationsreaktionen können auch stattfinden, wenn ein Stoff Elektronen an einen anderen Stoff abgibt, der als Reduktionsmittel wirkt. In solchen Reaktionen steigt der Oxidationszustand des abgebenden Stoffs. Oxidationsreaktionen spielen eine wichtige Rolle in vielen chemischen Reaktionen und sind in der Natur weit verbreitet.
Beispiele
- Verbrennung von Kohlenwasserstoffen: Bei der Verbrennung von Kohlenwasserstoffen wie Methan (CH4) mit Sauerstoff (O2) entstehen Kohlendioxid (CO2) und Wasser (H2O). Hierbei wird Methan oxidiert.
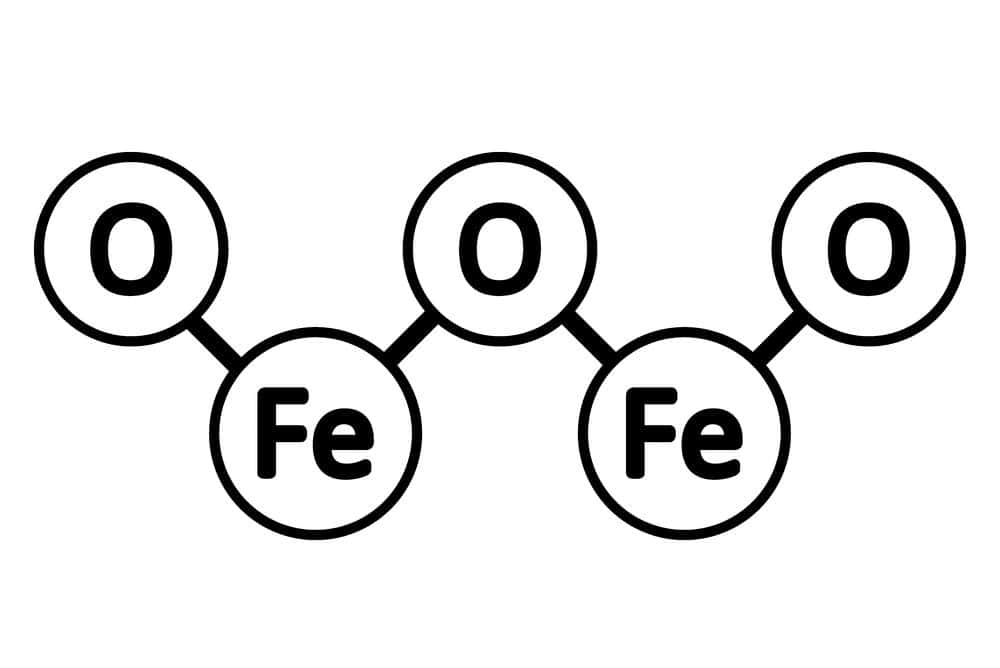
- Rostbildung: Die Reaktion von Eisen (Fe) mit Sauerstoff (O2) führt zur Bildung von Eisenoxid (Fe2O3), einem Prozess, der als Rostbildung bekannt ist. Die Reaktion von Eisen mit Sauerstoff führt zur Bildung von Eisenoxid, was als Rostbildung bekannt ist. Auch dies ist eine Oxidationsreaktion, da Eisen oxidiert wird.
Die Reaktion zwischen Eisen und Sauerstoff, bei der Eisen zu Eisenoxid oxidiert wird. Hier ist die chemische Formel für diese Reaktion:
4Fe + 3O2 -> 2Fe2O3
In dieser Reaktion verliert das Eisen Elektronen und erhöht seinen Oxidationszustand, was eine klassische Oxidationsreaktion darstellt.
Definition und Prinzipien der Oxidationsreaktion
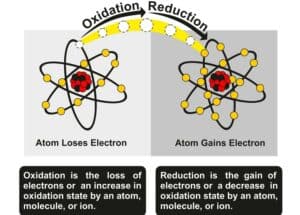
Eine Oxidationsreaktion ist eine spezifische Art der chemischen Reaktion, bei der ein Atom, Ion oder Molekül Elektronen abgibt. Diese Prozesse gehen stets mit einer Elektronenübertragung einher und sind daher häufig Bestandteil von sogenannten Redoxreaktionen. Bei diesen Reaktionen gibt es immer zwei Komponenten: den Elektronendonator, der Elektronen abgibt, und den Elektronenakzeptor, der diese Elektronen aufnimmt.
Ein zentrales Konzept in diesem Zusammenhang ist die Oxidationszahl, auch als Oxidationszustand bekannt. Diese Zahl hilft dabei zu bestimmen, wie viele Elektronen während einer Reaktion von einem Atom abgegeben oder aufgenommen wurden. Ein Anstieg der Oxidationszahl zeigt an, dass das Atom oxidiert wurde, während eine Verringerung darauf hinweist, dass das Atom reduziert worden ist.
Oxidationsreaktionen können entweder durch die direkte Aufnahme von Sauerstoff oder durch die Übertragung von Elektronen erfolgen. Dabei fungiert oft ein Oxidationsmittel als Elektronenakzeptor und ein Reduktionsmittel als Elektronendonator. Das chemische Gleichgewicht muss hierbei berücksichtigt werden, um sicherzustellen, dass die Reaktion tatsächlich abläuft.
Die grundlegenden Prinzipien der Oxidationsreaktion finden Anwendung in verschiedenen Bereichen der Chemie, einschließlich der Elektrochemie und der Energieumwandlung. Zum Beispiel erzeugen elektrochemische Zellen elektrische Energie durch gezielte Redoxprozesse. Ebenso spielen Oxidationsreaktionen im biologischen Bereich eine zentrale Rolle, insbesondere bei der Umwandlung von Nahrung in Energie in lebenden Organismen.
Chemie ist die Wissenschaft der Veränderung. Die Welt, wie wir sie kennen, wird durch Oxidations- und Reduktionsprozesse angetrieben. – Linus Pauling
| Begriff | Definition |
|---|---|
| Oxidationsreaktion | Eine chemische Reaktion, bei der Elektronen abgegeben werden. |
| Reduktion | Eine chemische Reaktion, bei der Elektronen aufgenommen werden. |
| Redoxreaktion | Eine chemische Reaktion, die aus einer gleichzeitigen Reduktion und Oxidation besteht. |
| Elektronendonator | Eine Substanz, die Elektronen abgibt. |
| Elektronenakzeptor | Eine Substanz, die Elektronen aufnimmt. |
| Oxidationsmittel | Eine Substanz, die als Elektronenakzeptor fungiert und andere Substanzen oxidiert. |
| Reduktionsmittel | Eine Substanz, die als Elektronendonator fungiert und andere Substanzen reduziert. |
| Oxidationszahl | Eine Zahl, die angibt, wie viele Elektronen bei einer Reaktion verloren oder gewonnen wurden. |
| Oxidationsprodukt | Das Endprodukt einer Oxidationsreaktion. |
| Elektrochemie | Der Bereich der Chemie, der sich mit dem Zusammenhang zwischen elektrischen und chemischen Phänomenen befasst. |
Arten von Oxidationsreaktionen
Eine chemische Reaktion, bei der Elektronen übertragen werden, wird als Redoxreaktion bezeichnet. Dabei gibt es verschiedene Arten von Oxidationsreaktionen, abhängig von der Art der Beteiligten und der durchgeführten Prozesse.
Ein typisches Beispiel ist die Sauerstoffaufnahme, was bedeutet, dass ein Stoff mit Sauerstoff reagiert. Bei dieser Reaktion fungiert Sauerstoff als das Oxidationsmittel, da er Elektronen aufnimmt und damit reduziert wird.
Ein weiterer Typ sind Oxidationen, bei denen keine Sauerstoffaufnahme erfolgt, sondern eine Elektronenübertragung von einem Elektronendonator zu einem Elektronenakzeptor stattfindet. Hierbei dient oft ein Reduktionsmittel als Elektronendonator und überträgt seine Elektronen auf den Akzeptor.
Besonders markant sind auch Verbrennungsreaktionen, bei denen organische Verbindungen in Anwesenheit von Sauerstoff oxidieren und dabei viel Energie freisetzen. Diese Reaktionen sind für viele Hochtemperaturprozesse entscheidend.
Ein bedeutendes Beispiel industrieller Anwendungen ist die Katalyse, bei der spezielle Substanzen genutzt werden, um die Geschwindigkeit einer Oxidationsreaktion zu erhöhen oder ihre Richtung zu steuern, ohne dabei selbst verbraucht zu werden. In elektrochemischen Zellen findet die Oxidation an der Anode statt und spielt eine zentrale Rolle bei elektrochemischen Reaktionen, wie etwa in Batterien und Brennstoffzellen.
All diese verschiedenen Oxidationsarten sind fundamental für das Verständnis vieler naturwissenschaftlicher und technischer Prozesse sowie für zahlreiche industrielle Anwendungen.
Beispiele für Oxidationsprozesse
Ein klassisches Beispiel für Oxidationsprozesse ist die Verbrennungsreaktion, bei der ein Stoff mit Sauerstoff reagiert und dabei Energie in Form von Wärme und Licht freigesetzt wird. Ein bekanntes Beispiel hierfür ist das Verbrennen von Holz oder Kohle, bei dem Kohlenstoffdioxid (CO₂) und Wasser (H₂O) als Produkte entstehen.
Eine weitere wichtige Gruppe von Oxidationsreaktionen sind die Prozesse in der Elektrochemie, insbesondere in elektrochemischen Zellen wie Batterien und Akkumulatoren. In einer solchen Zelle kommt es zur Elektronenübertragung zwischen einem Elektronendonator und einem Elektronenakzeptor. Hierbei wird durch den Fluss der Elektronen elektrische Energie erzeugt oder gespeichert.
Auch biologische Systeme nutzen Oxidationsreaktionen zur Energieumwandlung. Zum Beispiel beinhaltet die Zellatmung in Pflanzen und Tieren eine Reihe von Redoxreaktionen, bei denen Glukose oxidiert wird, um ATP – die universelle Energiequelle der Zelle – zu produzieren. Dabei fungiert Sauerstoff als das finale Oxidationsmittel und wird zu Wasser reduziert.
Im industriellen Bereich finden sich ebenfalls zahlreiche Anwendungen. Die Produktion von Metallen aus ihren Erzen erfolgt oft durch Redoxreaktionen. Hierbei werden die Metallionen durch Zugabe eines Reduktionsmittels in ihre metallische Form überführt.
Diese Beispiele verdeutlichen, wie vielseitig und allgegenwärtig Oxidationsprozesse im täglichen Leben sowie in technologischen und biologischen Systemen sind.
Anwendungen in der Chemie und Industrie
Oxidationsreaktionen spielen eine entscheidende Rolle in der Chemie und Industrie. Sie sind für die Herstellung vieler chemischer Produkte verantwortlich, wie z.B. organische Verbindungen, Farben und Pharmazeutika. Ein bekanntes Beispiel ist die Herstellung von Schwefelsäure, einem wichtigen Industriematerial, das durch die Oxidation von Schwefeldioxid gewonnen wird.
In der petrochemischen Industrie werden Oxidationsprozesse verwendet, um Rohöl in nützliche Produkte wie Benzin und Diesel umzuwandeln. Hierbei kommen raffinierte Technologien zum Einsatz, um die gewünschte Qualität und Effizienz zu erreichen.
Ein weiterer wichtiger Bereich ist die Katalyse, bei der Katalysatoren die Geschwindigkeit einer Reaktion erhöhen, ohne dabei selbst verbraucht zu werden. In vielen industriellen Prozessen dienen bestimmte Metalle als Katalysatoren für Oxidationsreaktionen, wobei sie helfen, die Aktivierungsenergie zu senken und die Produktivität zu steigern.
Oxidationsmittel sind auch wesentliche Komponenten in der Umwelttechnik zur Wasser- und Luftreinigung. Beispielsweise wird Ozon häufig zur Desinfektion eingesetzt, da es effektiv Bakterien und Viren oxidiert.
Darüber hinaus sind elektrochemische Zellen ein bedeutender Anwendungsbereich von Oxidationsreaktionen. Batterien und Brennstoffzellen wandeln chemische Energie effizient in elektrische Energie um, basierend auf den Prinzipien der Elektrochemie. Diese Technologien finden breite Anwendung in tragbaren Geräten, Elektrofahrzeugen und der nachhaltigen Energieversorgung.
Die Vielzahl der Anwendungen zeigt, wie vielseitig und unverzichtbar Oxidationsreaktionen in verschiedenen Industriezweigen sind. Die kontinuierliche Forschung und Entwicklung in diesem Bereich versprechen weitere Fortschritte und Innovationen.
Energieumwandlung in biologischen Systemen
Energieumwandlung in biologischen Systemen ist ein fundamentales Konzept, das die Basis vieler Lebensprozesse bildet. In lebenden Organismen spielt die Oxidationsreaktion eine entscheidende Rolle bei der Energiegewinnung.
Ein zentrales Beispiel für diesen Prozess ist die Zellatmung. Während dieser Reaktion wird Glukose oxidiert und hierbei wird Energie in Form von ATP (Adenosintriphosphat) produziert. Die oxidative Phosphorylierung findet in den Mitochondrien statt. Hier wirken Elektronenübertragung und Redoxreaktionen, um den notwendigen Protonengradienten aufzubauen, der zur Synthese von ATP führt.
Oxidationsmittel und Reduktionsmittel kommen kontinuierlich zum Einsatz. Sauerstoff fungiert als Elektronenakzeptor, während organische Substrate wie Glukose oder Fettsäuren die Rolle des Elektronendonators übernehmen. Diese Prozesse stellen sicher, dass chemisches Gleichgewicht und die Energieversorgung aufrechterhalten bleiben.
Ein bekanntes Oxidationsprodukt dieser Reaktionen ist Wasser, das beim Zusammenführen von Elektronen mit molekularem Sauerstoff entsteht. Der gesamte Reaktionsmechanismus der Zellatmung zeigt, wie präzise und effizient biologische Systeme aufgebaut sind.
Darüber hinaus gibt es auch andere biochemische Wege der Energieumwandlung, wie die Photosynthese in Pflanzen. Hierbei werden Lichtenergie und elektrochemische Zellen verwendet, um chemische Bindungen zu formen und somit Energievorräte wie Glukose herzustellen.
Diese komplexen Prozesse beweisen, wie grundlegend und vielfältig die Anwendung von Oxidationsreaktionen in biologischen Kontexten sein kann.
| Reaktionstyp | Beispiel | Anwendung |
|---|---|---|
| Oxidation | Verbrennung von Holz | Energiegewinnung durch Heizkraftwerke |
| Reduktion | Gewinnung von Metallen aus Erzen | Metallverarbeitung |
| Redoxreaktion | Zellatmung | Produktion von ATP in Zellen |
Verhinderung unerwünschter Oxidation
Um die unerwünschte Oxidation zu verhindern, sind verschiedene Methoden notwendig. Oxidation kann in vielen Fällen schädlich sein, beispielsweise wenn Metalle rosten oder Lebensmittel verderben. Eine wirksame Maßnahme ist der Einsatz von Antioxidantien. Antioxidantien wirken als Reduktionsmittel, indem sie selbst oxidiert werden und somit das eigentliche Material schützen.
Ein weiterer Ansatz zur Verhinderung unerwünschter Oxidation ist die Anwendung von Schutzschichten. Diese Schichten können physikalischer Natur sein, wie Lacke oder Beschichtungen, die den Zugang von Sauerstoff verhindern. In chemischen Prozessen kommen häufig Katalysatoren zum Einsatz, welche die Oxidation eines bestimmten Stoffes gezielt steuern und damit unerwünschte Nebenreaktionen minimieren.
Die Kontrolle der Umgebung spielt ebenfalls eine Schlüsselrolle. Die Reduktion des Sauerstoffgehalts durch Vakuumverpackung oder Lagerung in einer inerten Atmosphäre (zum Beispiel mit Stickstoff) kann die Oxidationsreaktion stark verlangsamen.
Eine präzise Überwachung der Temperatur und Feuchtigkeit sowie regelmäßige Wartung und Inspektion tragen dazu bei, oxidative Schäden frühzeitig zu erkennen und zu verhindern. So werden sowohl Produkte als auch Anlagen geschützt, was nicht nur die Lebensdauer verlängert, sondern auch die Qualität sicherstellt.
Bedeutung für die Umwelt
Oxidationsreaktionen spielen eine entscheidende Rolle bei vielen umweltrelevanten Prozessen. Eine der auffälligsten Anwendungen ist die Verbrennungsreaktion, bei der fossile Brennstoffe verbrannt werden, um Energie zu gewinnen. Dies führt jedoch zur Freisetzung von Kohlendioxid (CO₂) und anderen Treibhausgasen, was erheblich zum Klimawandel beiträgt.
Der Prozess der Sauerstoffaufnahme durch Oxidationsreaktionen ist ebenfalls zentral für den Abbau organischer Materialien in der Natur. Mikroorganismen nutzen diese Reaktionen, um Biomasse zu zersetzen und so Nährstoffe wieder in den Kreislauf zurückzuführen.
Hinzu kommt die Bedeutung von Oxidation bei der Wasseraufbereitung. Schädliche Substanzen können durch gezielte Oxidationsprozesse neutralisiert werden, wodurch sauberes Trinkwasser gewährleistet wird. Hierbei kommen oftmals starke Oxidationsmittel zum Einsatz.
Alte Metalle sind besonders anfällig für Korrosion, ein weiteres Beispiel einer naturbedingten Oxidation. Diese chemische Reaktion führt zur Zerstörung von Infrastruktur und erfordert ständige Wartungsarbeiten, was Ressourcen beansprucht. Allerdings kann die Verwendung von geeigneten Reduktionsmitteln helfen, dieses Problem zu mindern oder zu verhindern.
Zuletzt beeinflussen Oxidationsprozesse die Luftqualität maßgeblich. Schadstoffe wie Stickoxide entstehen durch industrielle Prozesse, Fahrzeuge und Kraftwerke. Technologische Fortschritte und Katalysatoren können helfen, diese Emissionen zu minimieren und somit die Umwelt besser zu schützen.
Zukünftige Entwicklungen und Forschungen
html formatted:
In der chemischen Forschung wird die Oxidationsreaktion weiterhin eine zentrale Rolle spielen. Ein bedeutender Schwerpunkt liegt auf der Entwicklung von neuen, umweltfreundlichen Oxidationsmitteln, die weniger schädliche Rückstände erzeugen und energieeffizienter arbeiten. Diese Fortschritte könnten erhebliche Auswirkungen auf industrielle Prozesse haben, indem sie die Nachhaltigkeit verbessern.
Ein weiterer vielversprechender Bereich ist die Untersuchung von Katalysemechanismen. Forscher sind bestrebt, effizientere Katalysatoren zu entwickeln, die spezifische Oxidationsprozesse unterstützen. Solche Innovationen könnten dazu beitragen, Ressourcen zu schonen und die Produktivität in verschiedenen Branchen zu steigern.
Im Feld der Elektrochemie zielt die aktuelle Forschung darauf ab, neue Materialien für elektrochemische Zellen zu entdecken, um deren Lebensdauer und Leistung zu erhöhen. Diese Entwicklungen sind insbesondere für die Verbesserung von Batterietechnologien von großer Bedeutung, da besser funktionierende Batterien eine Schlüsselrolle im Übergang zu erneuerbaren Energien spielen.
Schließlich wächst das Interesse an biologischen Systemen und organischen Molekülen, die natürliche Oxidationsprozesse optimieren. Durch das Studium dieser natürlichen Systeme hoffen Wissenschaftler, neue Ansätze für künstliche Anwendungen zu finden. Dies könnte unter anderem zur Erschließung neuer synthetischer Methoden führen, die nachhaltiger und ökologisch verträglicher sind.