Chemische Lösungen: Grundlagen und Anwendungen in der Chemie
Chemische Lösungen sind wichtige Elemente in der Wissenschaft und Technik. Sie bestehen aus chemischen Substanzen, die sich homogen miteinander vermischen. Eine grundlegende Eigenschaft von Lösungen ist ihre Fähigkeit, verschiedene Stoffe in einem Lösungsmittel aufzulösen, was oft als „Lösungsprozess“ bezeichnet wird.
Diese Prozesse spielen eine zentrale Rolle bei der Herstellung von Laborlösungen und technischen Chemikalien. Von flüssigen Gemischen bis hin zu festen Lösungen finden sie breite Anwendung in vielen Bereichen, darunter analytische Chemie und chemische Experimente. Die Zusammensetzung von Lösungen kann variieren, was wiederum deren Eigenschaften und Anwendungen beeinflusst.
Löslichkeit und Temperatur sind entscheidend für das Verhalten von chemischen Mischungen. Durch Veränderung der Temperatur lässt sich beispielsweise die Löslichkeit erhöhen oder verringern, was nützlich für bestimmte chemische Reaktionen sein kann. Dies eröffnet vielseitige Anwendungen und Analysemöglichkeiten im akademischen sowie industriellen Bereich.
Das Wichtigste in Kürze
- Grundlagen: Chemische Lösungen bestehen aus Stoffen, die sich homogen im Lösungsmittel vermischen.
- Arten: Es gibt flüssige, feste und gasförmige Lösungen, abhängig vom Aggregatzustand der Komponenten.
- Konzentration: Molarität und Massenprozent sind entscheidende Maße für die Konzentration der Lösungen.
- Löslichkeit: Temperatur und Druck beeinflussen die Löslichkeit der Stoffe in einem Lösungsmittel.
- Anwendungen: Chemische Lösungen sind wichtig in Laboren, Industrie, Medizin und im täglichen Leben.
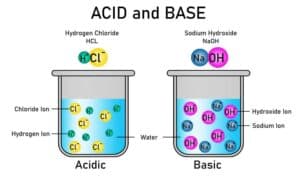
Chemische Lösungen sind homogene Gemische, die aus mindestens zwei chemischen Komponenten bestehen, wobei eine die Lösungsmittelkomponente ist, in der andere gelöst sind. In einer Lösung können die gelösten Stoffe (Lösungsstoffe) in einem anderen Stoff (Lösungsmittel) gleichmäßig verteilt sein, ohne dass sich Makroskopisch sichtbare Unterschiede abzeichnen. Lösungen spielen eine wichtige Rolle in vielen chemischen Prozessen und Reaktionen, da sie die Grundlage für die Durchführung von Reaktionen, die Herstellung von Produkten und vieles mehr bilden.
Beispiele aus der Chemie
- Natriumchloridlösung: NaCl in Wasser: NaCl (s) + H2O (l) -> Na^+ (aq) + Cl^- (aq)
- Kupfersulfatlösung: CuSO4 in Wasser: CuSO4 (s) + H2O (l) -> Cu^2+ (aq) + SO4^2- (aq)
- Salpetersäurelösung: HNO3 in Wasser: HNO3 (l) + H2O (l) -> H^+ (aq) + NO3^- (aq)
- Ammoniaklösung: NH3 in Wasser: NH3 (g) + H2O (l) -> NH4^+ (aq) + OH^- (aq)
- Schwefelsäurelösung: H2SO4 in Wasser: H2SO4 (l) + H2O (l) -> H^+ (aq) + HSO4^- (aq)
In der Chemie steht „(aq)“ für „aqueous“ und bedeutet, dass die betreffende chemische Spezies in einer wässrigen Lösung vorliegt. Es zeigt an, dass das entsprechende Ion oder Molekül in Wasser gelöst ist und von Wassermolekülen umgeben ist.
Beispiele aus dem Alltag
- Salzwasser: Hier ist Natriumchlorid (Salz) in Wasser gelöst.
- Zuckerwasser: Zucker ist in Wasser gelöst, um eine süße Lösung zu bilden.
- Essigsäurelösung: Essigsäure ist in Wasser gelöst, um Essig herzustellen.
- Luft: In der Luft sind Gase wie Sauerstoff, Stickstoff und Kohlendioxid homogen gemischt.
- Alkoholische Getränke: Alkohol ist in Wasser gelöst, um Getränke wie Wein oder Bier herzustellen.
- Seewasser: Hier sind verschiedene Salze und Mineralien in Wasser gelöst.
- Farbige Getränke: Lebensmittelfarbstoffe sind in Getränken wie Limonade oder Fruchtsaft gelöst.
- Medikamente: Wirkstoffe sind in Lösungen wie Sirup oder Tropfen formuliert.
- Reinigungsmittel: Chemische Reinigungsmittel enthalten gelöste Substanzen zur Reinigung von Oberflächen.
- Metalllegierungen: Metalle können in bestimmten Proportionen miteinander gemischt sein, um Legierungen wie Bronze oder Stahl zu bilden.
Chemisch gesehen ist Alkohol eine Lösung?
Chemisch gesehen ist Alkohol eine Lösung, wenn er in Wasser gelöst ist. Ethanol, der gebräuchlichste Alkohol in Getränken, kann in Wasser gelöst werden, um alkoholische Getränke wie Wein, Bier oder Spirituosen herzustellen. In diesem Sinne handelt es sich bei alkoholischen Getränken um Lösungen von Ethanol in Wasser.
Arten chemischer Lösungen
Chemische Lösungen können in verschiedene Typen eingeteilt werden, basierend auf dem Aggregatzustand der gelösten Substanz und des Lösungsmittels. Eine der häufigsten Arten ist flüssige Gemische. Hierbei handelt es sich um Lösungen, in denen ein Feststoff, eine Flüssigkeit oder ein Gas in einem flüssigen Lösungsmittel gelöst wird.
Ein weiteres Beispiel sind feste Lösungen, bei denen zwei oder mehr feste chemische Substanzen zusammen homogen gemischt werden. Diese Art von Lösung kommt häufig in Legierungen vor, wie etwa Stahl oder Bronze.
Gasförmige Lösungen sind ebenfalls sehr bekannt, insbesondere die Luft, die wir atmen. Luft ist eine Mischung aus verschiedenen Gasen wie Stickstoff, Sauerstoff und anderen Spuren-Gasen. Die chemische Zusammensetzung dieser gasförmigen Lösungen kann durch chemische Analysen bestimmt werden.
Laborlösungen spielen eine wichtige Rolle in der Chemiebereitung, sei es für analytische Chemie oder chemische Experimente. Ein prominentes Beispiel hierfür sind Salzlösungen, bei denen Salzkristalle in Wasser gelöst werden, um ionische Verbindungen zu erhalten.
Chemische Mischungen wie diese haben verschiedene Lösungsmitteleigenschaften, die ihre Verwendung in der Industrie und im Labor entscheidend beeinflussen. Die Auswahl des richtigen Lösungsmittels ist wichtig, da dies die Löslichkeit der Substanzen und die Effizienz der chemischen Reaktionen erheblich beeinflusst.
Chemie ist die Wissenschaft über die Zusammensetzung und Umwandlung von Materie. – Dmitri Mendelejew
| Eigenschaft | Beschreibung |
|---|---|
| Aggregatzustand | Fest, Flüssig, Gasförmig |
| Löslichkeit | Hängt von der Temperatur, dem Lösungsmittel und der Substanz ab |
| Konzentration | Wird in Molarität oder Stoffmengenkonzentration angegeben |
| Lösungsmitteleigenschaften | Polare oder unpolare Lösungsmittel |
Eigenschaften von Lösungen
Chemische Lösungen sind homogene Gemische aus zwei oder mehr Substanzen, bei denen eine Substanz (das Lösungsmittel) die andere (den gelösten Stoff) auflöst. Die Eigenschaften von Lösungen hängen maßgeblich von der Art und den Mengen der beteiligten chemischen Substanzen ab.
Eine wichtige Eigenschaft ist die Löslichkeit, also die maximale Menge eines gelösten Stoffs, die in einem bestimmten Lösungsmittel gelöst werden kann. Diese kann stark variieren und ist oft abhängig von Temperatur und Druck. Zum Beispiel lösen sich Gase besser in Flüssigkeiten bei niedrigeren Temperaturen und höherem Druck.
Lösungen haben auch physikalische Eigenschaften wie Dichte, Viskosität und Oberflächenspannung. Die Dichte einer Lösung ändert sich in Abhängigkeit von der Konzentration des gelösten Stoffs. Je mehr Stoff gelöst ist, desto dichter wird die Lösung normalerweise.
Ein weiteres Merkmal ist die Leitfähigkeit. Elektrolytlösungen, welche Ionen enthalten, können elektrischen Strom leiten, während Lösungen aus nicht-elektrolytischen Substanzen dies nicht können.
Zudem ändern sich der Siedepunkt und Gefrierpunkt einer Lösung durch Zugabe von gelösten Stoffen. Dieses Phänomen wird als Siede- bzw. Gefrierpunktserniedrigung bezeichnet und ist insbesondere für Chemiebereitungen relevant.
Zusätzlich spielen chemische Reaktionen eine Rolle in Lösungen. Einige Reaktionen finden nur statt, wenn die reagierenden Substanzen gelöst vorliegen, was in der analytischen Chemie und bei chemischen Experimenten häufig ausgenutzt wird.
Konzentrationsangaben
Das genaue Bestimmen der Konzentration von chemischen Lösungen ist essenziell für verschiedene wissenschaftliche und industrielle Anwendungen. Es gibt mehrere Methoden, die verwendet werden können, um die Menge eines gelösten Stoffes in einer Lösung zu messen.
Ein gängiger Begriff im Zusammenhang mit Konzentrationsangaben ist die Molarität, die oft auch als Stoffmengenkonzentration bezeichnet wird. Diese gibt an, wie viele Mol eines gelösten Stoffs in einem Liter Lösung enthalten sind. Eine andere wichtige Angabe ist das Massenprozent, welches den Anteil der Masse des gelösten Stoffes an der Gesamtmasse der Lösung beschreibt.
Analytische Chemie befasst sich intensiv mit der exakten Konzentrationsbestimmung. Verschiedene Techniken wie Titration oder Photometrie können eingesetzt werden, um zuverlässige Ergebnisse zu erzielen. In Laborlösungen spielt die Genauigkeit dieser Angaben eine kritische Rolle, da ungenaue Daten die Resultate chemischer Analysen verfälschen könnten.
Auch in der industriellen Chemiebereitung von technischen Chemikalien kommen präzise Konzentrationsangaben zum Einsatz. So können gleichbleibende Eigenschaften und Qualitäten bei der Herstellung von Lösungen gewährleistet werden.
Die Bedeutung der richtigen Zusammensetzung von Lösungen zeigt sich besonders bei chemischen Experimenten, wo exakte Mengen nötig sind, um erwartete Reaktionen hervorzurufen. Mithilfe präziser Konzepte der Lösungskonzentrationen werden diese Prozesse kontrollierbar und reproduzierbar.
Letztlich tragen genaue Angaben zur Konzentration zur Sicherheit bei: Für die Verwender chemischer Substanzen ist es wichtig zu wissen, welche Mengen sie handhaben, um korrekt mit festen und flüssigen Gemischen (chemischen Mischungen) umzugehen.
Stoffmengenkonzentration und Molarität
Die Stoffmengenkonzentration, auch als Molarität bezeichnet, ist ein grundlegender Begriff in der Chemie. Sie gibt die Menge einer chemischen Substanz in Mol an, gelöst in einem Liter Lösung. Die Stoffmengenkonzentration ist wichtig, um Reaktionsgleichungen zu berechnen und chemische Mischungen präzise zu erstellen.
Ein Mol entspricht 6.022 x 10^23 Teilchen (Atome, Moleküle oder Ionen). Diese Zahl wird als Avogadro-Konstante bezeichnet. Wenn man also von einer 1-molaren Lösung spricht, enthält diese genau ein Mol des aufgelösten Stoffs pro Liter Lösung. Dies ermöglicht es Wissenschaftlern, genaue Mengenverhältnisse chemischer Substanzen zu bestimmen und Reaktionen durchzuführen.
Warum sollte nun die Molarität verwendet werden? Ein Vorteil liegt darin, dass sie unkompliziert die Anzahl der Teilchen angibt, was besonders bei chemischen Reaktionen und Berechnungen nützlich ist. Bei der Vorbereitung von Laborlösungen kann man so sicherstellen, dass die Konzentration genau den Anforderungen der geplanten Experimente entspricht.
Um eine molare Lösung herzustellen, misst man zunächst die benötigte Menge des reinen Stoffes ab und löst diesen dann in einem geeigneten Lösungsmittel, bis das gewünschte Volumen erreicht ist. Zum Beispiel: Um eine 1-molare Salzlösung herzustellen, würde man 58,44 Gramm Natriumchlorid (NaCl) – das Gewicht von einem Mol NaCl – in genügend Wasser lösen, um einen Liter Gesamtvolumen zu erhalten.
Mithilfe dieser Methoden lassen sich nicht nur sehr konzentrierte Lösungen, sondern auch verdünnte Lösungen herstellen, indem man die Stammlösung mit zusätzlichem Lösungsmittel mischt.
Löslichkeit und Temperatur
Die Löslichkeit einer chemischen Substanz beschreibt, wie gut sie sich in einem Lösungsmittel auflösen kann. Ein entscheidender Faktor für die Löslichkeit ist die Temperatur. Allgemein gilt: Mit steigender Temperatur nimmt die Löslichkeit vieler fester und flüssiger Stoffe in einem Lösungsmittel zu.
Dies liegt daran, dass höhere Temperaturen die Teilchenbewegung verstärken, wodurch die Teilchen der gelösten Substanz besser verteilt werden können. Zum Beispiel lösen sich Zucker und Salz bei höherer Temperatur schneller und in größeren Mengen in Wasser als bei niedrigen Temperaturen.
Jedoch verhält es sich bei Gasen oft anders. Mit steigender Temperatur nimmt die Löslichkeit von Gasen in Flüssigkeiten ab. Ein bekanntes Beispiel ist Kohlendioxid in Limonade. Je wärmer die Limonade wird, desto weniger Kohlendioxid kann darin verbleiben, was dazu führt, dass das Getränk schal wird.
Chemische Reaktionen laufen bei verschiedenen Temperaturen unterschiedlich ab, was ebenfalls die Löslichkeit beeinflussen kann. Die exothermen oder endothermen Eigenschaften eines Lösungsprozesses spielen hier eine bedeutende Rolle.
Bei der Chemiebereitung im Labor sind diese Kenntnisse essenziell. Hier müssen Techniker und Forscher die perfekte Balance zwischen Temperatur und Löslichkeit finden, um die gewünschten Ergebnisse zu erzielen. Wichtig ist auch, die spezifischen Lösungsmitteleigenschaften jedes Stoffes zu kennen, da nicht jede Kombination gleich gut funktioniert.
Kennen Sie die Zusammensetzung Ihrer Lösungen und berücksichtigen Sie immer die möglichen Auswirkungen der Temperatur.
| Eigenschaft | Beispielsubstanz | Beschreibung |
|---|---|---|
| Aggregatzustand | Wasser (flüssig) | Wahrnehmbarer physikalischer Zustand wie fest, flüssig oder gasförmig |
| Löslichkeit | NaCl (Salz) | Fähigkeit eines Stoffes, sich in einem Lösungsmittel aufzulösen |
| Konzentration | 1 M NaOH | Quantität des gelösten Stoffs in einem bestimmten Volumen der Lösung |
| Temperaturabhängigkeit | CO2 in Wasser | Einfluss der Temperatur auf die Löslichkeit eines Stoffes |
Verdünnung und Mischung von Lösungen
Die Verdünnung und Mischung von Lösungen sind zentrale Konzepte in der analytischen Chemie. Bei der Verdünnung wird die Konzentration einer Lösung durch Zugabe eines Lösungsmittels, meist Wasser, verringert. Dies ist wichtig für chemische Experimente, bei denen genaue Lösungskonzentrationen erforderlich sind.
Bei der Mischung von Lösungen werden zwei oder mehr Lösungen kombiniert, um eine neue Zusammensetzung zu erzeugen. Hierbei kann es zu chemischen Reaktionen kommen, abhängig von den eingesetzten chemischen Substanzen. Dies ist entscheidend für die Herstellung von Laborlösungen und technischen Chemikalien.
Beim Mischen ist es essenziell, die Volumina und Stoffmengen genau zu messen, um gewünschte Konzentrationsbestimmungen zu erreichen. Ein sorgfältiger Umgang mit den Lösungsmitteln und korrekte Berechnungen stellen sicher, dass das Endprodukt die geplanten Eigenschaften besitzt. Besonders bei der Chemiebereitung müssen diese Lösungsprozesse präzise durchgeführt werden, um Fehler zu vermeiden.
In vielen Fällen ist auch die Temperaturkontrolle notwendig, da die Löslichkeit von Substanzen temperaturabhängig sein kann. Beim Mischen und Verdünnen erweist sich oft ein fundiertes Verständnis der chemischen Formeln als nützlich, insbesondere wenn komplexe stoffgemische hergestellt werden sollen.
Anwendungen und Beispiele chemischer Lösungen
Chemische Lösungen sind in vielen Bereichen unverzichtbar. In der analytischen Chemie werden Lösungen genutzt, um die Zusammensetzungen von Stoffgemischen zu bestimmen. Zum Beispiel können Forscher durch die Verwendung von Laborlösungen spezifizierte chemische Reaktionen auslösen und beobachten.
Ein weiteres Anwendungsgebiet ist die Herstellung von Lösungen für medizinische Zwecke. Salzhaltige Lösungen, sogenannte physiologische Kochsalzlösungen, werden verwendet, um den Flüssigkeitshaushalt im Körper zu regulieren oder Medikamente zu verdünnen und direkt ins Blut zu verabreichen.
In der industriellen Produktion kommen Lösungen häufig als technische Chemikalien zum Einsatz. Zum Beispiel verwenden Metallverarbeitungsbetriebe Säurelösungen, um Metalle zu reinigen und Oberflächen vorzubereiten. Auch in der Lebensmittelindustrie werden Lösungen eingesetzt, etwa in Form von Essig- und Zuckerlösungen zur Konservierung und Geschmackgebung.
Im Alltag treffen wir ebenfalls auf viele chemische Mischungen. Reinigungsmittel enthalten oft wassergelöste Substanzen, die Flecken und Schmutz effektiv entfernen. Selbst Getränke wie Kaffee und Tee sind flüssige Gemische, bei denen sich wasserlösliche Stoffe wie Koffein und Aromastoffe lösen.
Somit spielen chemische Lösungen eine bedeutende Rolle sowohl in wissenschaftlichen und industriellen Prozessen als auch in unserem täglichen Leben.
Sicherheit im Umgang mit chemischen Lösungen
Die Handhabung von chemischen Lösungen erfordert besondere Aufmerksamkeit und Sorgfalt, um sicherzustellen, dass keine gesundheitlichen Risiken oder Schäden entstehen. Wenn man mit Laborlösungen arbeitet, ist es wichtig, immer auf die spezifischen Eigenschaften der beteiligten chemischen Substanzen zu achten. Dies beginnt bereits beim sorgfältigen Lesen der Sicherheitsdatenblätter (SDS), die wichtige Informationen über Gefahren und Schutzmaßnahmen enthalten.
Eine sichere Vorgehensweise schließt das Tragen geeigneter Schutzausrüstung wie Handschuhe und Schutzbrillen ein. Chemische Reaktionen können manchmal unerwartete Ergebnisse liefern, daher sollte der Arbeitsplatz stets gut belüftet sein, und entsprechende Notfalleinrichtungen wie Augenspülstationen sollten bereitstehen.
Chemikalien niemals ohne vorherige Kenntnis ihrer Lösungsmitteleigenschaften mischen; dies könnte gefährliche Dämpfe freisetzen oder andere Gefahren verursachen. Auch bei der Herstellung von Lösungen ist Vorsicht geboten: Vermeiden Sie Spritzer, indem Sie langsam und kontrolliert arbeiten und nach Möglichkeit eine Abzughaube nutzen.
Besonders bei der Verdünnung konzentrierter Stoffe ist es entscheidend, dies korrekt durchzuführen, da stark exotherme Prozesse auftreten können. Konzentrationsbestimmung und exakte Zusammensetzung von Lösungen müssen genau beachtet werden, um chemische Experimente erfolgreich und sicher durchzuführen.
Um Unfälle und Verwechslungen zu vermeiden, kennzeichnen Sie alle Behältnisse klar und präzise. Letztlich sind Verantwortung und Umsicht wesentliche Bestandteile im korrekten Umgang mit chemischen Mischungen, um sowohl eigene Sicherheit als auch die der Umgebung zu gewährleisten.