Der Aufbau von Salzen genauer angeschaut
Der Aufbau der Salze in der Chemie stellt einen fundamentalen Bereich dieses Fachs dar. Salze, bestehend aus positiven und negativen Ionen, bilden ein kristallines Gitter, das durch starke elektrische Anziehungen zusammengehalten wird. Diese ionischen Kristalle weisen spezifische geometrische Strukturen auf, die ihre grundlegenden Eigenschaften wie elektrische Leitfähigkeit und Löslichkeit beeinflussen.
Salze spielen eine zentrale Rolle sowohl in der Natur als auch in industriellen Anwendungen. Ihre Bildung und Dissoziation in wässrigen Lösungen sind entscheidende Vorgänge, die vielfältige chemische Reaktionen ermöglichen. Temperatur und Druck haben dabei stets einen signifikanten Einfluss auf die Salzstrukturen, was wiederum deren Verhalten unter unterschiedlichen Bedingungen bestimmt.
Das Wichtigste in Kürze
- Salze bestehen aus positiven und negativen Ionen, die ein kristallines Gitter bilden.
- Im festen Zustand leiten Salze keinen Strom, in Lösung oder geschmolzen jedoch schon.
- Die Löslichkeit von Salzen variiert stark je nach Zusammensetzung und Temperatur.
- Temperatur und Druck beeinflussen die Stabilität und Struktur der Salz-Kristallgitter.
- Salze sind in Natur und Industrie vielseitig einsetzbar und essenziell für viele Prozesse.
Salze bestehen aus positiv geladenen Metallionen und negativ geladenen Nichtmetallionen. Diese Ionen lagern sich in einem regelmäßigen Gitter an und bilden so die kristalline Struktur der Salze. Die Eigenschaften und Struktur der Salze hängen maßgeblich von diesem Aufbau ab.
Chemische Bindungen und Gitterstrukturen der Salze
Der Aufbau der Salze in der Chemie basiert auf spezifischen chemischen Bindungen und Gitterstrukturen. Die primäre Art dieser Bindung ist die Ionenbindung, bei welcher positive und negative Ionen durch elektrostatische Kräfte zusammengehalten werden. Diese Ionen entstehen, wenn Metallatome Elektronen abgeben und Nichtmetallatome diese aufnehmen.
Im festen Zustand bilden die Ionen ein regelmäßiges Kristallgitter, dessen Geometrie durch die Größe und Ladung der Ionen bestimmt wird. Typische Strukturen sind das kubisch flächenzentrierte oder das kubisch raumzentrierte Gitter. Diese Kristallstrukturen verleihen den Salzen ihre charakteristischen physikalischen Eigenschaften wie Härte und Schmelzpunkt.
Ein wesentliches Merkmal des ionischen Kristalls ist seine Fähigkeit, elektrische Leitfähigkeit zu zeigen, wenn er geschmolzen oder in Wasser gelöst wird. Dies liegt daran, dass die Ionen im festen Zustand fixiert sind, aber sich in Lösung oder Schmelze frei bewegen können.
Die Löslichkeit von Salzen variiert stark je nach ihrer Zusammensetzung. Während einige Salze sehr gut in Wasser löslich sind, gibt es andere, die nur schwer löslich sind. Dies ist auf die Wechselwirkungen zwischen den Ionen und den Wassermolekülen zurückzuführen.
Zusätzlich beeinflussen Temperatur und Druck die Stabilität der Salzstruktur. Hohe Temperaturen können zu einem Aufbrechen der Gitterstruktur führen, während hoher Druck bestimmte Salzformen bevorzugen kann.
Das Studium der Kristallstruktur der Salze gehört zu den grundlegendsten und faszinierendsten Bereichen der Chemie. – Linus Pauling
| Eigenschaft | Beschreibung |
|---|---|
| Elektrische Leitfähigkeit | Salze leiten im geschmolzenen Zustand oder in Lösung elektrischen Strom, da die Ionen frei beweglich sind. |
| Löslichkeit | Die Löslichkeit von Salzen variiert stark, abhängig von den Wechselwirkungen zwischen den Ionen und Wassermolekülen. |
| Kristallstruktur | Die Geometrie der Kristallgitter wird durch die Größe und Ladung der Ionen bestimmt, z.B. kubisch flächenzentriert oder kubisch raumzentriert. |
| Einfluss von Temperatur | Hohe Temperaturen können zur Auflösung der Kristallstruktur und zum Schmelzen des Salzes führen. |
| Einfluss von Druck | Hoher Druck kann bestimmte Salzstrukturen stabilisieren oder bevorzugen. |
Ionenbindung: Wechselwirkungen positiver und negativer Ionen
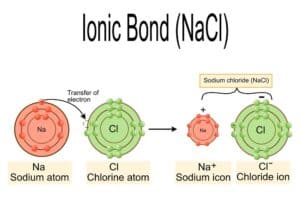
Der Aufbau der Salze in der Chemie beginnt mit dem Verständnis der Ionenbindung, die zwischen positiven und negativen Ionen stattfindet. Diese Bindung entsteht, wenn ein Elektron von einem Atom auf ein anderes übertragen wird, wodurch Kationen (positiv geladene Ionen) und Anionen (negativ geladene Ionen) gebildet werden.
Kationen bestehen meist aus Metallatomen, während Anionen oft von Nichtmetallen abgeleitet werden. Die elektrostatische Anziehungskraft zwischen den entgegengesetzt geladenen Ionen ist verantwortlich für die Stabilität des gesamten Salzgitters. Ein klassisches Beispiel solcher Verbindungen ist Natriumchlorid (NaCl), wo Natrium als Kation und Chlorid als Anion vorkommen.
Diese elektrostatischen Wechselwirkungen sind stark genug, dass sie ein regelmäßiges Kristallgitter bilden, welches das eigentliche Merkmal vieler Salze ist. Als Folge bildet sich eine spezielle Struktur, die aufgrund ihrer symmetrischen und stabilen Natur verschiedene physikalische Eigenschaften wie hohe Schmelz- und Siedepunkte besitzt.
Ein entscheidender Aspekt dieser ionischen Bindungen ist ihre Fähigkeit, sich in polaren Lösungen wie Wasser zu dissoziieren. In wässrigen Lösungen brechen die Gitterstrukturen auf, und die Ionen verteilen sich homogen im Medium. Dies erklärt auch die gute elektrische Leitfähigkeit von salzhaltigen Lösungen, da die beweglichen Ionen als Ladungsträger fungieren.
Insgesamt spielt die Ionenbindung eine zentrale Rolle bei der Bildung und den Eigenschaften von Salzen.
Ionische Kristalle und ihre Geometrie
- Ionische Bindung: Salze bestehen aus ionischen Gittern, die durch elektrostatische Anziehung zwischen positiv geladenen Metallionen und negativ geladenen Nichtmetallionen gebildet werden.
- Kristallstruktur: Die Kristallstruktur von Salzen ist regelmäßig und geometrisch angeordnet, was zu einer stabilen Gitterstruktur führt.
- Geometrie der Ionen: Die Ionen in ionischen Kristallen sind so angeordnet, dass sie eine bestimmte geometrische Form bilden, um die elektrostatische Anziehung zu maximieren.
Ionische Kristalle sind Feststoffe, deren Struktur aus einem dreidimensionalen Netz von Ionen besteht. Diese Anordnung wird durch die elektrostatische Anziehungskraft zwischen positiv geladenen Kationen und negativ geladenen Anionen stabilisiert. Ein klassisches Beispiel für einen ionischen Kristall ist Natriumchlorid (Kochsalz), der eine kubische Gitterstruktur besitzt.
Die Geometrie eines ionischen Kristalls hängt von mehreren Faktoren ab. Erstens spielen die Größe und die Ladung der beteiligten Ionen eine entscheidende Rolle. Größere Ionen oder höhere Ladungen bewirken unterschiedliche Abstände und Winkel innerhalb des Gitters. Zweitens bestimmt das Verhältnis der Radien von Kation und Anion die Art des gebildeten Gitters. Eine gängige Regel in der Chemie ist, dass Kationen meist kleiner als ihre entsprechenden Anionen sind, was sich auf die Packungsdichte des Kristalls auswirkt.
Ein weiterer wichtiger Aspekt ist die Koordinationszahl, welche die Anzahl der nächstgelegenen Nachbarionen beschreibt. Zum Beispiel hat Natriumchlorid eine Koordinationszahl von sechs, was bedeutet, dass jedes Na+-Ion von sechs Cl–Ionen umgeben ist und umgekehrt. Dies führt zu einer sehr stabilen und kompakten Struktur.
Ionische Kristalle können auch Defekte in ihrer Struktur aufweisen, wie etwa Leerstellen oder Zwischengitteratome. Solche Defekte sind oft verantwortlich für verschiedene physikalische Eigenschaften, einschließlich elektrischer Leitfähigkeit und Lichtdurchlässigkeit. Die Anordnung und Geometrie dieser Kristalle sind daher nicht nur ein faszinierender Gegenstand wissenschaftlicher Studien, sondern haben auch weitreichende praktische Anwendungen.
Eigenschaften elektrischer Leitfähigkeit und Löslichkeit
Salze besitzen interessante Eigenschaften, wenn es um ihre elektrische Leitfähigkeit und Löslichkeit geht. Im festen Zustand leiten die meisten Salze keinen elektrischen Strom, da die Ionen in einer starren Gitterstruktur gebunden sind und somit nicht frei bewegen können. Wird ein Salz jedoch geschmolzen oder in Wasser gelöst, zerbricht das Gitter und die Ionen werden mobil. Diese freien Ionen ermöglichen dann die elektrische Leitfähigkeit.
Die Löslichkeit von Salzen in Wasser ist von ihrer spezifischen Kristallstruktur und den Wechselwirkungen zwischen den Ionen sowie dem Lösungsmittel abhängig. Einige Salze wie Natriumchlorid lösen sich leicht in Wasser, während andere deutlich schlechter löslich sind. Dies hängt mit der Energiebilanz zwischen Gitterenergie des Salzes und Hydrationsenergie der Wassermoleküle zusammen.
Beim Lösen in Wasser kommt es zur Dissoziation der Ionen: Die positiven und negativen Ionen trennen sich und werden von Wassermolekülen umgeben. Dadurch wird die elektrische Leitfähigkeit ermöglicht, da die Ionen nun frei durch die Lösung wandern können und als Ladungsträger fungieren.
Die Temperatur spielt auch eine wichtige Rolle bei der Löslichkeit und Leitfähigkeit von Salzen. In vielen Fällen erhöht eine höhere Temperatur die Löslichkeit eines Salzes in Wasser. Dadurch steigt die Konzentration der mobilen Ionen, was zu einer verbesserten Leitfähigkeit führt.
Bildung und Dissoziation in wässrigen Lösungen
Bei der Bildung und Dissoziation von Salzen in wässrigen Lösungen spielt die Auflösung des Salzgitters eine entscheidende Rolle. Wenn ein Salz wie Natriumchlorid (NaCl) in Wasser gegeben wird, zerfällt es in seine Bestandteile: Natrium-Ionen (Na+) und Chlorid-Ionen (Cl–). Diese Ionen sind im Wasser hydratisiert, d.h., sie werden von Wassermolekülen umgeben.
Dieser Prozess wird als Dissoziation bezeichnet. Er ermöglicht es den Ionen, sich frei im Wasser zu bewegen, was zur elektrischen Leitfähigkeit der Lösung führt. Ein charakteristisches Merkmal dieser Lösungen ist ihre Fähigkeit, Strom zu leiten. Das liegt daran, dass die beweglichen Ionen als Ladungsträger agieren.
Im Gegensatz dazu beschreibt die Kristallisation die Umkehr dieses Prozesses, bei dem Ionen aus der Lösung zurück in eine feste Gitterstruktur übergehen. Dies kann durch Verdampfen des Wassers oder Abkühlen der Lösung geschehen. Während der Kristallisation ordnen sich die Ionen regelmäßig an, wodurch ein festes Salz entsteht.
Die Bildung und Dissoziation beeinflussen auch die Löslichkeit eines Salzes. Faktoren wie Temperatur spielen hier eine Rolle; höhere Temperaturen führen oft zu einer höheren Löslichkeit. Bei einigen Salzen kann jedoch die Löslichkeit mit sinkender Temperatur zunehmen.
| Ionentyp | Beispiele | Eigenschaften |
|---|---|---|
| Kationen | Natrium (Na+), Kalium (K+) | Positiv geladen, oft von Metallen abgeleitet |
| Anionen | Chlorid (Cl–), Sulfat (SO42-) | Negativ geladen, meist von Nichtmetallen abgeleitet |
| Komplexe Ionen | Ammonium (NH4+), Nitrid (N3-) | Spezifische Zusammensetzungen, oft in Kombinationen zu finden |
Einfluss von Temperatur und Druck auf Salzstrukturen
Die Struktur von Salzen kann erheblich von äußeren Bedingungen wie Temperatur und Druck beeinflusst werden. Wenn die Temperatur erhöht wird, können sich die Gitterstrukturen der Salze verändern. Dies liegt daran, dass die thermische Bewegung der Ionen intensiver wird. Bei bestimmten Temperaturen können die Ionen in eine andere kristalline Ordnung übergehen oder sogar schmelzen, wobei sie ihre feste Form verlieren.
Druck spielt ebenfalls eine entscheidende Rolle. Bei erhöhtem Druck können Salze dichter gepackt werden, was zur Bildung neuer Kristallstrukturen führen kann. Beispielsweise können einige Salze unter extrem hohem Druck in eine Form mit höherer Dichte konvertieren, die bei normalen Bedingungen nicht stabil ist. Solche Phasenübergänge sind häufig reversibel, wenn sich Druckbedingungen wieder ändern.
Durch die Berücksichtigung dieser Einflussfaktoren können Wissenschaftler die Eigenschaften bestimmter Salze gezielt verändern. Dies ist besonders nützlich für industrielle Anwendungen, wo bestimmte physikalische und chemische Eigenschaften gefordert sind. Das Verständnis dieser Wechselwirkungen hilft auch dabei, natürliche Prozesse besser zu verstehen. So kann zum Beispiel erklärt werden, warum bestimmte Minerale nur in bestimmten Tiefen der Erdkruste vorkommen.
Temperatur: Die Temperatur beeinflusst die Bewegung der Ionen in der Salzstruktur. Bei höheren Temperaturen können die Ionen schneller vibrieren und die Gitterstruktur destabilisieren.
Druck: Der Druck kann die Abstände zwischen den Ionen in der Salzstruktur verändern. Ein hoher Druck kann dazu führen, dass die Ionen enger zusammengepackt sind, während ein niedriger Druck zu einer lockereren Struktur führen kann.
Phasenübergänge: Veränderungen in Temperatur und Druck können zu Phasenübergängen in Salzstrukturen führen, z.B. von fest zu flüssig oder umgekehrt, je nach den spezifischen Bedingungen.
Anwendungen und Vorkommen in Natur und Industrie
Salze finden vielfältige Anwendungen sowohl in der Natur als auch in der Industrie. Ein sehr bekanntes Salz, das Natriumchlorid (Kochsalz), spielt eine entscheidende Rolle im menschlichen Stoffwechsel und ist unverzichtbar für den Haushalt.
In der Industrie dienen Salze wie Natriumnitrat oder Kaliumdichromat als wichtige Ausgangsstoffe bei der Herstellung von Düngemitteln. Zudem werden sie in vielen chemischen Prozessen eingesetzt. So wird beispielsweise Calciumcarbonat zur Produktion von Zement verwendet.
Auch in der Natur sind Salze weit verbreitet. Meerwasser enthält zahlreiche gelöste Salze, die für Meereslebewesen lebensnotwendig sind. Die entstandenen riesigen Salzlagerstätten kommen durch das Verdunsten früherer Ozeane zustande. Auch Mineralien wie Halit (Steinsalz) und Calcit bestehen zum Großteil aus verschiedenen Salzen.
Zudem spielen Salze eine bedeutende Rolle in medizinischen Anwendungen; Kochsalzlösungen werden beispielsweise in der Medizin zur Infusionstherapie genutzt. Sie helfen dabei, das Volumen des Blutplasmas zu erhöhen oder Elektrolyt-Ungleichgewichte zu korrigieren.
Ein weiteres spannendes Anwendungsgebiet ist die Nutzung von Salzen in Batterien und Akkumulatoren. Lithium-Ionen-Batterien enthalten Lithiumsalze, um elektrische Energie effizient speichern und abgeben zu können.
So zeigt sich, dass Salze aufgrund ihrer einzigartigen Eigenschaften und vielfältigen Struktur sowohl in der Natur als auch in zahlreichen Industriezweigen von großem Nutzen sind.