Ionenbindung Salz NaCl (depositphotos.com)
Ionen bei Salze
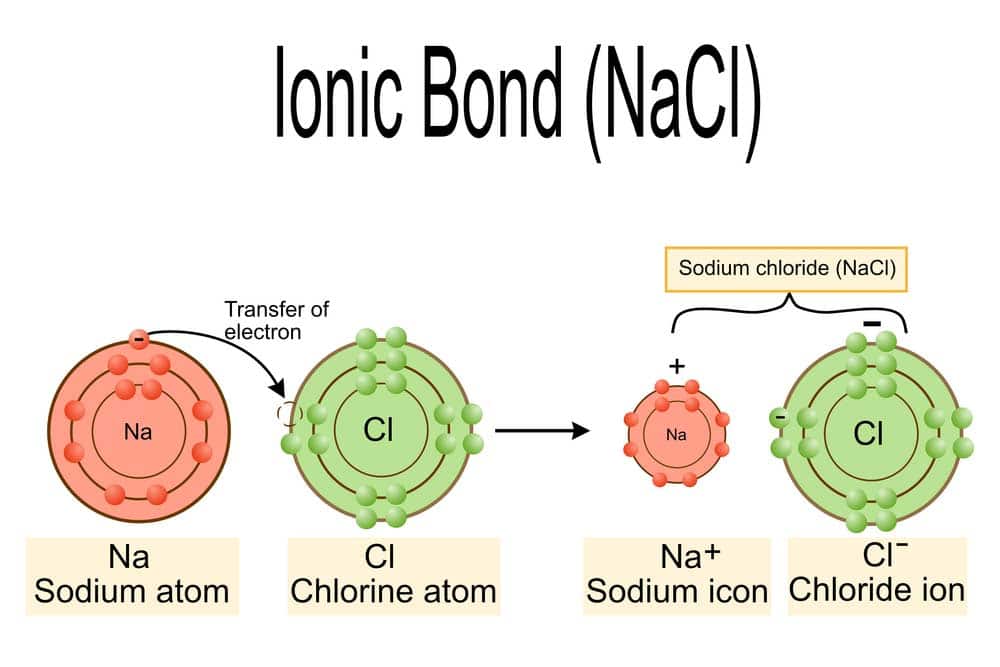
Die Ionenbindung ist eine fundamentale chemische Verbindung zwischen Metallkationen und Nichtmetallanions. Sie entsteht durch den Transfer von Elektronen, wodurch Ionen gebildet werden. Diese Ionen lagern sich in einer spezifischen Kristallstruktur an und bilden ein stabiles Feststoffgitter.
Eine herausragende Eigenschaft ionischer Verbindungen sind ihre hohen Schmelz- und Siedepunkte. Dies liegt an der starken Anziehungskraft zwischen den Ionen, den sogenannten Ionenkräften. Auch die elektrische Leitfähigkeit wird beeinflusst: In wässriger Lösung oder im geschmolzenen Zustand leiten Salze elektrischen Strom. Die Löslichkeit in Wasser variiert stark und hängt ebenfalls von den beteiligten Ionen ab.
Im kristallinen Zustand ordnen sich Kationen und Anionen in einem Gitter an. Dabei spielt die Gitterenergie eine entscheidende Rolle für die Stabilität des Salzes. Faktoren wie Ionengröße und Ladung der Ionen beeinflussen diese Energie und damit auch die Eigenschaften des entstehenden Feststoffgitters.
Das Wichtigste in Kürze
- Ionenbindung entsteht durch Elektronentransfer zwischen Metallen (Kationen) und Nichtmetallen (Anionen).
- Stabile Kristallstrukturen resultieren aus starken elektrostatischen Anziehungen (Ionenkräfte).
- Hohe Schmelz- und Siedepunkte kennzeichnen ionische Verbindungen aufgrund hoher Gitterenergie.
- Elektrische Leitfähigkeit in wässriger Lösung und geschmolzenem Zustand durch frei bewegliche Ionen.
- Löslichkeit in Wasser variiert und hängt von Gitterenergie und Ionengröße ab.
Die Ionenbindung der Salze in der Chemie ist eine wichtige Art der chemischen Bindung. Sie entsteht durch die Anziehung zwischen positiv geladenen Metallionen und negativ geladenen Nichtmetallionen. Diese elektrostatische Anziehungskraft führt zur Bildung eines stabilen ionischen Gitters, das die Struktur der Salze bestimmt. Die Ionenbindung sorgt dafür, dass die Ionen in einem festen Verhältnis zueinander angeordnet sind und verleiht den Salzen ihre charakteristischen Eigenschaften.
Beispiele für die Ionen bei Salzen
- Natriumion (Na+): Positiv geladenes Ion, das in Salzen wie Natriumchlorid vorkommt.
- Chloridion (Cl-): Negativ geladenes Ion, das in Salzen wie Natriumchlorid vorkommt.
- Calciumion (Ca2+): Positiv geladenes Ion, das in Salzen wie Calciumcarbonat vorkommt.
- Sulfation (SO42-): Negativ geladenes Ion, das in Salzen wie Bariumsulfat vorkommt.
- Kaliumion (K+): Positiv geladenes Ion, das in Salzen wie Kaliumnitrat vorkommt.
- Nitration (NO3-): Negativ geladenes Ion, das in Salzen wie Kaliumnitrat vorkommt.
- Magnesiumion (Mg2+): Positiv geladenes Ion, das in Salzen wie Magnesiumsulfat vorkommt.
- Hydroxidion (OH-): Negativ geladenes Ion, das in Salzen wie Natriumhydroxid vorkommt.
- Ammoniumion (NH4+): Positiv geladenes Ion, das in Salzen wie Ammoniumchlorid vorkommt.
- Phosphation (PO43-): Negativ geladenes Ion, das in Salzen wie Calciumphosphat vorkommt.
- Eisen(II)-ion (Fe2+): Positiv geladenes Ion, das in Salzen wie Eisen(II)-sulfat vorkommt.
- Carbonation (CO32-): Negativ geladenes Ion, das in Salzen wie Natriumcarbonat vorkommt.
Bindung zwischen Metallkationen und Nichtmetallanions
Im Bereich der Chemie spielen die Bindungen zwischen Metallkationen und Nichtmetallanions eine zentrale Rolle bei der Bildung von Salzen. Bei dieser Art der Bindung handelt es sich um die sogenannte Ionenbindung, die durch den Transfer von Elektronen vom Metall zum Nichtmetall entsteht.
Metalle neigen dazu, Elektronen zu verlieren und bilden dadurch positiv geladene Ionen, die als Kationen bezeichnet werden. Nichtmetalle hingegen nehmen diese Elektronen auf und bilden negativ geladene Ionen, die man Anionen nennt. Diese entgegengesetzt geladenen Ionen ziehen sich dank starker elektrostatischer Kräfte gegenseitig an und formen dadurch stabile Verbindungen.
Ein wesentlicher Aspekt dieses Phänomens ist die daraus resultierende Kristallstruktur. Die Kation und Anion Anordnung im Feststoffgitter folgt einem bestimmten Muster, das die Stabilität des gesamten Gitters sicherstellt. Aufgrund der starken Anziehungskräfte zwischen den Ionen weist das so gebildete Kristallgitter eine hohe Gitterenergie auf.
Die hohe Gitterstabilität macht ionische Verbindungen zudem bemerkenswert widerstandsfähig gegenüber äußeren Einflüssen. Trotz ihrer hohen Stabilität besitzen sie Variabilität in ihren Eigenschaften, abhängig von der Größe der beteiligten Ionen (Ionengröße) und der spezifischen Anordnung innerhalb des Gitters.
Die Bindung von Ionen zu einem Gitter ist eine faszinierende Demonstration der Naturgesetze, die selbst in den kleinsten Partikeln wirken. – Wilhelm Ostwald
| Eigenschaft |
Beschreibung |
| Kristallstruktur |
Anordnung der Ionen in einem Gittermuster |
| Gitterenergie |
Energie, die das Gitter zusammenhält und seine Stabilität bestimmt |
| Ionenkräfte |
Elektrostatische Anziehungskräfte zwischen Kationen und Anionen |
| Feststoffgitter |
Struktur, die durch die regelmäßige Anordnung von Ionen entsteht |
| Kation und Anion Anordnung |
Die spezifische Platzierung von positiven und negativen Ionen im Gitter |
| Schmelzpunkt |
Temperatur, bei der das Salz vom festen in den flüssigen Zustand übergeht |
| Löslichkeit in Wasser |
Fähigkeit des Salzes, sich in Wasser zu lösen |
| Elektrische Leitfähigkeit |
Fähigkeit, elektrischen Strom in Lösung oder im geschmolzenen Zustand zu leiten |
| Ionengröße |
Größe der an der Bindung beteiligten Ionen, beeinflusst die Gitterenergie |
| Gitterstabilität |
Robustheit und Widerstandsfähigkeit des Kristallgitters |
Elektronentransfer und Ionenbildung
Die Ionenbindung entsteht durch den Elektronentransfer zwischen Atomen, meist zwischen Metallen und Nichtmetallen. Bei diesem Prozess gibt ein Metallatom eines oder mehrere seiner Außenelektronen ab, wobei es zu einem positiv geladenen Ion (Kation) wird. Das Nichtmetall hingegen nimmt diese Elektronen auf und bildet dadurch ein negativ geladenes Ion (Anion). Dieser Austausch von Elektronen führt zu einer energetisch stabileren Anordnung der Atome.
Ein Beispiel dafür ist das Natriumchlorid (NaCl), bei dem ein Natriumatom seine Valenzelektronen an ein Chloratom abgibt. Diesem Übergang folgt die elektrostatische Anziehung zwischen dem Kation und dem Anion, welche zur Bildung einer festen Struktur führt. Diese starken Kräfte zwischen den entgegengesetzt geladenen Ionen sind als ionische Bindungen bekannt.
In einem Feststoffgitter wie bei Salzen ordnen sich die Kationen und Anionen in einer regelmäßig wiederholenden Kristallstruktur an. Durch diese geordnete Anordnung minimieren sie ihre Energie und maximieren die Stabilität des Systems. Die resultierende Struktur hat eine hohe Gitterenergie, was bedeutet, dass viel Energie erforderlich ist, um das Gitter zu brechen und die Substanz zu schmelzen oder zu verdampfen.
Zusammengefasst können wir sagen, dass der Elektronentransfer der zentrale Mechanismus hinter der Entstehung von Ionenbindungen ist und damit die Basis für die Bildung vieler Alltagsverbindungen bildet.
Kristallgitterstruktur und Stabilität
- Kristallgitterstruktur: Die Ionen in den Salzen sind in einem regelmäßigen, dreidimensionalen Gitter angeordnet, das sich durch die Ionenbindung bildet. Diese Struktur sorgt für eine hohe Ordnung und Stabilität in den Salzen.
- Ionengitter: Die Ionen sind in einem festen Verhältnis zueinander angeordnet und bilden ein stabiles Gitter, das durch die elektrostatische Anziehung zwischen den entgegengesetzt geladenen Ionen zusammengehalten wird.
- Stabilität: Die Stabilität der Kristallgitterstruktur von Salzen wird durch die Ionenbindung und die regelmäßige Anordnung der Ionen gewährleistet. Störungen in diesem Gitter können die Eigenschaften und Struktur der Salze verändern.
Die Kristallgitterstruktur von Salzen spielt eine entscheidende Rolle für deren Stabilität. Bei der Bildung eines Salzgitters ordnen sich die Ionen in einer regelmäßigen, dreidimensionalen Struktur an, bekannt als Kristallgitter. Diese Struktur minimiert die potentielle Energie des Systems durch die Wechselwirkungen zwischen den Kationen und Anionen.
In einem typischen Feststoffgitter befinden sich Kationen und Anionen in alternierender Position, sodass jede positive Ladung von negativen umgeben ist und vice versa. Diese Anordnung maximiert die elektrostatische Anziehungskraft zwischen entgegengesetzt geladenen Ionen und trägt so zur hohen Stabilität des Gitters bei. Die Stärke dieser Anziehungskraft wird als Gitterenergie bezeichnet und sie ist ein Maß dafür, wie stabil das Gitter ist.
Je höher die Gitterenergie, desto stabiler ist das Kristallgitter und desto schwerer ist es zu schmelzen oder verdampfen. Dies erklärt auch, warum viele Salze sehr hohe Schmelzpunkte haben.
Darüber hinaus hängt die Stabilität eines Ionenkristalls auch von der Größe der Ionen ab. Kleinere Ionen können dichter zusammengepackt werden, was ebenfalls die Gitterenergie erhöht.
Zusammenfassend lässt sich sagen, dass die Eigenschaften des Kristallgitters – insbesondere Anordnung und Größe der Ionen – maßgeblich die Stabilität und physikalischen Eigenschaften eines Salzes bestimmen.
Eigenschaften von ionischen Verbindungen
Ionische Verbindungen zeichnen sich durch eine Vielzahl besonderer Eigenschaften aus. Eine der auffälligsten ist ihr hoher Schmelzpunkt. Die starke elektrostatische Anziehung zwischen den Ionen sorgt dafür, dass viel Energie benötigt wird, um das Kristallgitter zu überwinden und die Substanz in einen flüssigen Zustand zu überführen.
Ein weiteres wichtiges Merkmal ist ihre Löslichkeit in Wasser. Viele ionische Verbindungen lösen sich gut in Wasser, da die Wassermoleküle die Ionen im Kristallgitter umgeben und dadurch die starken Ionenkräfte aufbrechen können. Dieser Prozess führt zur Bildung hydratisierter Ionen, was wiederum die elektrische Leitfähigkeit der Lösung erhöht.
Im festen Zustand sind ionische Verbindungen allerdings nicht elektrisch leitfähig. Dies liegt daran, dass die Ionen im Feststoffgitter fixiert sind und somit keine Bewegungsfreiheit haben, um elektrischen Strom zu leiten. In geschmolzenem Zustand oder gelöstem Zustand hingegen können sich die Ionen frei bewegen, wodurch die elektrische Leitfähigkeit steigt.
Die Härte und Sprödigkeit ionischer Verbindungen resultieren aus der festen Gitterstruktur. Aufgrund dieser stabilen Struktur sind sie oft sehr hart, brechen aber leicht, wenn genug Kraft angewendet wird. Dieses Verhalten hängt auch von der Größe der Ionen ab, die die Gitterenergie und damit die Stabilität des Kristalls beeinflusst.
Nicht zuletzt spielen diese Eigenschaften zusammen mit der spezifischen Anordnung der Kationen und Anionen eine wichtige Rolle für die allgemeine Gitterstabilität solcher Substanzen.
Schmelz- und Siedepunkte von Salzen
Die Schmelz- und Siedepunkte von Salzen sind in der Regel relativ hoch. Dies liegt daran, dass die Ionen in einem Salz stark durch elektrostatische Anziehungskräfte, auch bekannt als Ionenkräfte, zusammengehalten werden. Diese Kräfte erfordern eine erhebliche Menge an Energie, um überwunden zu werden, weshalb die Temperatur, bei der ein Salz schmilzt oder siedet, höher ist als bei vielen anderen Arten von Verbindungen.
Innerhalb eines ionischen Feststoffgitters sind die Kationen und Anionen in einer regelmäßigen Kristallstruktur angeordnet. Die Stärke dieser Struktur wird wesentlich von der Gitterenergie bestimmt. Die Gitterenergie ist die Energie, die freigesetzt wird, wenn gasförmige Ionen sich zu einem Feststoff zusammenschließen. Salze mit hoher Gitterenergie haben daher auch hohe Schmelz- und Siedepunkte.
Ein weiterer entscheidender Faktor ist die Größe der Ionen. Kleinere Ionen können näher zueinander kommen und erzeugen stärkere elektrostatische Anziehungen, was die Stabilität des Gitters erhöht und folglich höhere Temperaturen für das Schmelzen und Sieden erforderlich macht. Umgekehrt können größere Ionen diese Anziehungskraft reduzieren, was zu niedrigeren Schmelz- und Siedepunkten führt.
Zudem spielt die Art der Anordnung der Kationen und Anionen im Feststoffgitter eine wichtige Rolle. Eine geordnete Anordnung trägt zur Stabilität des Kristallgitters bei, was ebenfalls zu höheren Schmelz- und Siedepunkt Temperaturen beiträgt. Zusammen nehmen all diese Aspekte Einfluss auf die thermischen Eigenschaften von Salzen und erklären ihre oft bemerkenswert hohen Schmelz- und Siedepunkte.
| Faktor | Einfluss | Beispiel |
| Kristallgitter | Bestimmt Stabilität und physikalische Eigenschaften | NaCl-Struktur |
| Gitterenergie | Menge an Energie notwendig für das Brechen des Gitters | Hohe Werte bei MgO |
| Ionenradius | Beeinflusst die Anordnung und die Gitterstabilität | Vergleich zwischen Li+ und Na+ |
Elektrische Leitfähigkeit in Lösungen
Ionische Verbindungen sind in fester Form keine guten Leiter von Elektrizität, da die Ionen in einem starren Kristallstruktur fixiert sind und sich nicht bewegen können. Wenn sie jedoch in Wasser gelöst werden oder geschmolzen sind, ändern sich ihre Leitfähigkeitseigenschaften erheblich.
Beim Lösen eines Salzes wie Natriumchlorid (NaCl) im Wasser zerfällt es in seine Bestandteile–Kationen (Na+) und Anionen (Cl–). Diese frei beweglichen Ionen tragen zur elektrischen Leitfähigkeit der Lösung bei. Die Anwesenheit dieser freien Ladungsträger erklärt, warum Salzlösungen Strom leiten können.
Die Fähigkeit einer Lösung, elektrischen Strom zu leiten, hängt weitgehend von der Konzentration der gelösten Ionen ab. Je höher die Konzentration der Ionen, desto besser ist die elektrische Leitfähigkeit. Diese Eigenschaft wird oft durch eine Messgröße namens Leitfähigkeit oder Konduktivität quantifiziert.
Der Prozess des Schmelzens führt ebenfalls zu einer erhöhten Bewegung der Ionen innerhalb des Feststoffgitters. Wie bei gelösten Salzen ermöglicht die erhöhte Mobilität der Ionen im geschmolzenen Zustand den Transport von elektrischer Ladung.
Zusammengefasst: In ionischen Lösungen und Schmelzen können die Ionen aufgrund ihrer Beweglichkeit zur Effizienz der elektrischen Leitfähigkeit beitragen.
Löslichkeit von Salzen in Wasser
Salze lösen sich in Wasser aufgrund der Wechselwirkungen zwischen den geladenen Ionen und den Wassermolekülen. Wenn ein Salz in Wasser gelöst wird, umgeben die polaren Wassermoleküle die Ionen des Salzes. Dieses Phänomen ist als Hydratation bekannt. Dabei richten sich die teilweise negativ geladenen Sauerstoffatome der Wassermoleküle zu den positiven Kationen, während die positiv geladenen Wasserstoffatome zu den negativen Anionen ausgerichtet sind.
Ein wichtiger Aspekt dieser Lösungsvorgänge ist die Gitterenergie des Feststoffgitters des Salzes. Diese Energie muss überwunden werden, damit die Ionen frei ins Wasser diffundieren können. Die Menge an Gitterenergie hängt von der Stärke der Ionenkräften ab, welche wiederum durch die Ladung und Größe der Ionen bestimmt wird. Kleine Ionen mit hoher Ladungsdichte haben tendenziell eine höhere Gitterenergie als große Ionen oder solche mit niedrigerer Ladungsdichte.
Beispielsweise sind Natriumchlorid (NaCl) und Kaliumchlorid (KCl) sehr gut wasserlöslich, da ihre Gitterenergien relativ gering sind im Vergleich zu anderen Salzen wie Calciumcarbonat (CaCO3). Zudem ermöglicht die spezifische Anordnung der Kationen und Anionen das effiziente Brechen des Ionengitters bei Kontakt mit Wasser.
Die Löslichkeit in Wasser kann auch durch Faktoren beeinflusst werden wie Temperatur und pH-Wert des Lösungsmittels. Bei höheren Temperaturen besitzen die Wassermoleküle mehr kinetische Energie, was die Löslichkeit vieler Salze erhöht.
Nicht alle Salze sind jedoch vollständig löslich in Wasser. Beispielsweise fällt Ammoniumhexachloroplatinat schwer löslich aus. Dies zeigt, wie variabel die Interaktion zwischen kristallinen Strukturen und Lösungsmittel sein kann.
Beispiele:
- Natriumchlorid (Kochsalz): Sehr gut in Wasser löslich.
- Kaliumnitrat: Gut in Wasser löslich.
- Calciumcarbonat (Kalk): Kaum in Wasser löslich.
- Natriumhydrogencarbonat (Natron): Mäßig in Wasser löslich.
- Kaliumchlorid: Gut in Wasser löslich.
- Bariumsulfat: Kaum in Wasser löslich.
- Zinksulfat: Mäßig in Wasser löslich.
- Silberchlorid: Kaum in Wasser löslich.
- Kaliumiodid: Gut in Wasser löslich.
Anwendungen und Beispiele ionischer Verbindungen
Ionische Verbindungen finden sich in vielen Bereichen unseres täglichen Lebens sowie in verschiedenen industriellen Anwendungen. Ein bekanntes Beispiel ist Natriumchlorid, allgemein als Speisesalz bekannt, das in der Küche unverzichtbar ist.
In der Medizin werden ionische Verbindungen wie Kaliumchlorid eingesetzt, um den Elektrolythaushalt im Körper auszugleichen. Außerdem spielt Calciumphosphat eine wichtige Rolle im Aufbau von Knochen und Zähnen.
Die Landwirtschaft nutzt ionische Verbindungen sehr effektiv. So wird Ammoniumnitrat häufig als Dünger verwendet, um Pflanzen mit notwendigem Stickstoff zu versorgen. In der Wasseraufbereitung hilft Eisen(III)-sulfat dabei, Verunreinigungen aus dem Wasser zu entfernen.
Industriell gesehen haben wir viele nützliche Anwendungsmöglichkeiten für ionische Verbindungen. Zum Beispiel sind Lithium-ionen-Batterien wesentliche Bestandteile moderner Elektronikgeräte wie Smartphones und Laptops. Diese Batterien zeichnen sich durch ihre hohe Energiedichte und lange Lebensdauer aus.
Zusammengefasst bieten ionische Verbindungen zahlreiche Einsatzmöglichkeiten, sei es in alltäglichen Produkten oder spezialisierten technischen Anwendungen. Ihre besondere Kristallstruktur und die auftretenden Ionenkräften machen sie sowohl stabil als auch vielseitig einsetzbar.
Anwendungsbeispiele:
- Kochsalz (Natriumchlorid): Wird in der Lebensmittelindustrie als Gewürz und Konservierungsmittel verwendet.
- Kaliumnitrat: Verwendung in der Pyrotechnik für Feuerwerkskörper.
- Calciumcarbonat (Kalk): Einsatz als Baustoff, z.B. in der Herstellung von Mörtel und Beton.
- Natriumhydrogencarbonat (Natron): Verwendung als Backtriebmittel in Backpulver.
- Kaliumchlorid: Verwendung als Düngemittel in der Landwirtschaft.
- Bariumsulfat: Einsatz als Kontrastmittel bei Röntgenuntersuchungen.
- Zinksulfat: Verwendung in der Medizin als Nahrungsergänzungsmittel.
- Silberchlorid: Einsatz in der Fotografie als lichtempfindliches Material.
- Kaliumiodid: Verwendung in der Medizin zur Behandlung von Schilddrüsenerkrankungen.
FAQs
Was ist die Rolle der Gitterenergie bei der Löslichkeit von Salzen?
Die Gitterenergie beeinflusst die Menge an Energie, die erforderlich ist, um die Ionen im Kristallgitter zu trennen. Eine hohe Gitterenergie bedeutet, dass mehr Energie benötigt wird, um das Salz in Wasser zu lösen, was tendenziell zu einer geringeren Löslichkeit führt.
Warum haben ionische Verbindungen hohe Schmelzpunkte?
Ionische Verbindungen haben hohe Schmelzpunkte, weil die starken elektrostatischen Anziehungskräfte zwischen den Kationen und Anionen große Mengen an Energie erfordern, um überwunden zu werden. Diese starken Kräfte halten die Ionen fest in einem stabilen Kristallgitter zusammen.
Können sich ionische Verbindungen auch in anderen Lösungsmitteln als Wasser lösen?
Ja, ionische Verbindungen können sich auch in anderen polaren Lösungsmitteln wie Ethanol oder Methanol lösen. Die Fähigkeit zur Lösung hängt von den Wechselwirkungen zwischen den polaren Molekülen des Lösungsmittels und den Ionen des Salzes ab.
Welche Faktoren beeinflussen die elektrische Leitfähigkeit von Salzlösungen?
Die elektrische Leitfähigkeit von Salzlösungen wird hauptsächlich durch die Konzentration der Ionen, die Temperatur der Lösung und die Art der gelösten Ionen beeinflusst. Eine höhere Ionenkonzentration und Temperatur führen in der Regel zu einer besseren Leitfähigkeit.
Warum sind ionische Verbindungen im festen Zustand spröde?
Ionische Verbindungen sind im festen Zustand spröde, weil die Kationen und Anionen in einem festen Kristallgitter fixiert sind. Wenn eine ausreichende äußere Kraft angewendet wird, verschieben sich die Ebenen der Ionen gegeneinander, was zu einem Bruch des Gitters führt.
Welche Rolle spielen ionische Verbindungen in der Umweltchemie?
Ionische Verbindungen spielen eine wichtige Rolle in der Umweltchemie, insbesondere bei Prozessen wie der Wasseraufbereitung, der Bodenverbesserung und der Reduzierung von Umweltverschmutzung. Sie können helfen, Schadstoffe aus dem Wasser zu entfernen und die Nährstoffverfügbarkeit im Boden zu verbessern.
Gibt es Ausnahmen bei der elektrischen Leitfähigkeit von ionischen Verbindungen?
Ja, es gibt Ausnahmen. Einige ionische Verbindungen wie festes Silberchlorid (AgCl) sind elektrische Nichtleiter, da ihre Ionen sehr fest im Gitter gehalten werden und sich bei Raumtemperatur kaum bewegen können.