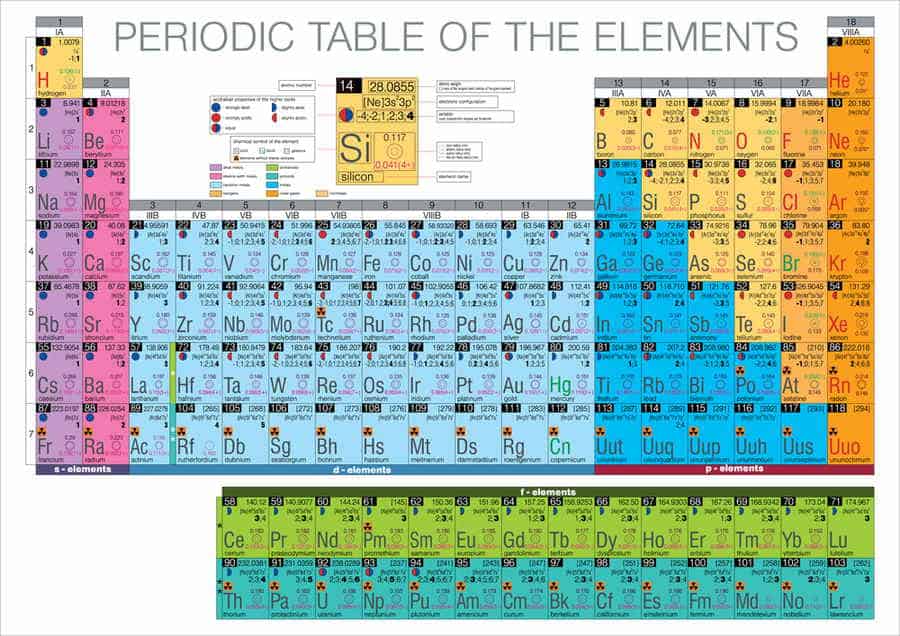
Das Periodensystem: Alle chemischen Elemente: A-Z Übersicht
Die chemischen Elemente sind die grundlegenden Bausteine der Materie, aus denen alles besteht. Jedes Element ist im Periodensystem durch ein eindeutiges Chemisches Symbol gekennzeichnet, das aus einem oder zwei Buchstaben besteht. Diese Kurzbezeichnungen erleichtern die Darstellung und Kommunikation in der Chemie erheblich. Die chemische Notation erlaubt es Wissenschaftlerinnen und Wissenschaftlern, komplexe Reaktionen und Verbindungen präzise zu beschreiben.
Von den leuchtenden Edelgasen bis hin zu den reaktionsfreudigen Übergangsmetallen spielt jedes Element eine einzigartige Rolle in verschiedenen Bereichen. Während Edelgase aufgrund ihrer Stabilität kaum reagieren, sind Elemente wie Eisen und Kupfer in vielen industriellen Anwendungen unersetzlich. Auch in biologischen Systemen finden sich zahlreiche Elemente wieder, die für den Stoffwechsel und andere Prozesse unerlässlich sind.
Das Periodensystem listet alle bekannten Elemente systematisch auf und stellt ihre Eigenschaften übersichtlich dar. Es umfasst sowohl Hauptgruppenelemente als auch Übergangsmetalle. Chemische Symbole und Abkürzungen helfen nicht nur in wissenschaftlichen Texten, sondern auch in der Ausbildung und Lehre. Dank dieser genormten Darstellungen können chemische Vorgänge weltweit klar und einheitlich kommuniziert werden.
Das Wichtigste in Kürze
- Chemische Elemente sind die Basis der Materie, dargestellt im Periodensystem.
- Jedes Element hat ein eindeutiges Symbol und eine spezifische Ordnungszahl.
- Edelgase sind stabil, während Übergangsmetalle wie Eisen industriell wichtig sind.
- Elemente sind lebenswichtig, z.B. Sauerstoff für Atemprozesse und Eisen für Blutbildung.
- Synthetische Elemente werden in Laboren erzeugt und erweitern das Periodensystem.
| Element | Abkürzung |
|---|---|
| Actinium | Ac |
| Aluminium | Al |
| Americium | Am |
| Antimon | Sb |
| Argon | Ar |
| Barium | Ba |
| Beryllium | Be |
| Bismut | Bi |
| Bohrium | Bh |
| Bor | B |
| Brom | Br |
| Cadmium | Cd |
| Calcium | Ca |
| Californium | Cf |
| Cer | Ce |
| Cäsium | Cs |
| Chlor | Cl |
| Chrom | Cr |
| Cobalt | Co |
| Curium | Cm |
| Darmstadtium | Ds |
| Dubnium | Db |
| Dysprosium | Dy |
| Einsteinium | Es |
| Erbium | Er |
| Europium | Eu |
| Eisen | Fe |
| Fermium | Fm |
| Flerovium | Fl |
| Fluor | F |
| Francium | Fr |
| Gadolinium | Gd |
| Gallium | Ga |
| Germanium | Ge |
| Gold | Au |
| Hafnium | Hf |
| Hassium | Hs |
| Helium | He |
| Holmium | Ho |
| Indium | In |
| Iod | I |
| Jod | I |
| Kalium | K |
| Kadmium | Cd |
| Kupfer | Cu |
| Lanthan | La |
| Lawrencium | Lr |
| Lithium | Li |
| Livermorium | Lv |
| Lutetium | Lu |
| Magnesium | Mg |
| Mangan | Mn |
| Meitnerium | Mt |
| Molybdän | Mo |
| Natrium | Na |
| Neodym | Nd |
| Neon | Ne |
| Nihonium | Nh |
| Niob | Nb |
| Nickel | Ni |
| Nihonium | Nh |
| Natrium | Na |
| Neodym | Nd |
| Nobelium | No |
| Osmium | Os |
| Phosphor | P |
| Palladium | Pd |
| Platin | Pt |
| Polonium | Po |
| Praseodym | Pr |
| Protactinium | Pa |
| Radium | Ra |
| Radon | Rn |
| Rhenium | Re |
| Rhodium | Rh |
| Rubidium | Rb |
| Ruthenium | Ru |
| Rutherfordium | Rf |
| Sauerstoff | O |
| Samarium | Sm |
| Scandium | Sc |
| Schwefel | S |
| Seaborgium | Sg |
| Selen | Se |
| Silber | Ag |
| Stickstoff | N |
| Strontium | Sr |
| Tantal | Ta |
| Technetium | Tc |
| Tellur | Te |
| Tennessin | Ts |
| Terbium | Tb |
| Thallium | Tl |
| Thorium | Th |
| Thulium | Tm |
| Titan | Ti |
| Tungsten | W |
| Uran | U |
| Vanadium | V |
| Wasserstoff | H |
| Wolfram | W |
| Xenon | Xe |
| Ytterbium | Yb |
| Yttrium | Y |
| Zink | Zn |
Allgemeiner Überblick der chemischen Elemente
Die chemischen Elemente bilden die Grundlage der gesamten Materie im Universum. Jedes Element ist durch seine einzigartige Anzahl von Protonen im Atomkern definiert, eine Eigenschaft, die als „Ordnungszahl“ bekannt ist. Diese Vielfalt wird im Periodensystem der Elemente strukturiert dargestellt.
Das Periodensystem ordnet die Elemente in Zeilen und Spalten an, basierend auf ihrer Elektronenkonfiguration und wiederkehrenden chemischen Eigenschaften. Vertikale Spalten werden als „Gruppen“ bezeichnet und enthalten Elemente mit ähnlichen chemischen Verhalten. Horizontale Reihen heißen „Perioden“. Die genaue Anordnung hilft dabei, Trends wie Reaktivität, Elektronegativität und Ionisationsenergie vorherzusagen.
Jedes Element hat ein offizielles Symbol, bestehend aus ein oder zwei Buchstaben – dies sind die sogenannten Chemische Symbole. Zum Beispiel steht „H“ für Wasserstoff und „O“ für Sauerstoff. Diese Chemical symbols erleichtern die Darstellung und das Verständnis chemischer Reaktionen erheblich.
Es gibt insgesamt 118 offiziell benannte Elemente, wobei viele natürlich vorkommen, während einige nur künstlich in Laboratorien erzeugt wurden. Da sich neue Techniken entwickeln, bleibt die Entdeckung potenziell neuer Elemente ein spannendes Gebiet der Forschung. Chemische Notationen helfen, die komplexen Zusammenhänge zwischen den verschiedenen Elementen einfacher darzustellen.
Obwohl jedes Element einzigartig ist, starre Regeln zur Klassifizierung gefolgt: ob Metalle, Halbmetalle oder Nichtmetalle. Das Wissen um die Verwendung und die Natur dieser Bausteine der Welt hat immense Fortschritte in Wissenschaft und Industrie ermöglicht.
Die Chemie öffnet die Tür zu einer unendlichen Welt des Wissens, in der jedes Element eine Geschichte erzählt. – Marie Curie
Historische Entdeckung und Namensgebung

Die Entdeckung und Namensgebung chemischer Elemente ist eine faszinierende Geschichte, die bis ins antike Griechenland zurückreicht. Bereits die frühen Philosophen wie Demokrit und Leukippos entwickelten erste Theorien über die Grundbausteine der Materie. Jedoch dauerte es bis zum 17. und 18. Jahrhundert, bevor Wissenschaftler methodische Experimente durchführten und konkrete Elemente identifizierten.
Viele Elemente wurden nach ihren besonderen Eigenschaften benannt, während andere nach ihren Entdeckern oder deren Herkunftsorte bezeichnet wurden. Zum Beispiel wurde das Element Plutonium nach dem Planeten Pluto benannt, wobei dieses Element auch als Teil einer Gruppe betrachtet wird, zu der Uran und Neptunium gehören. Auch bei chemischen Symbolen finden sich häufig historische Wurzeln: Das Symbol Pb für Blei stammt vom lateinischen Wort „Plumbum“.
Im Laufe der Zeit entwickelte sich für jedes Element ein einzigartiges chemisches Symbol, das heute im Periodensystem festgehalten ist. Die Vergabe dieser Symbole folgt strengen internationalen Richtlinien, um Verwechslungen zu vermeiden und gewährleistet so die Einheitlichkeit wissenschaftlicher Kommunikation weltweit.
Einige Elemente tragen auch Namen berühmter Wissenschaftler wie Einsteinium, das nach Albert Einstein benannt wurde. Die Benennung von Elementen spiegelt also nicht nur deren chemische Notationen wider, sondern auch kulturelle und historische Einflüsse, was diese Disziplin besonders vielseitig und interessant macht.
| Element | Chemisches Symbol |
|---|---|
| Wasserstoff | H |
| Sauerstoff | O |
| Eisen | Fe |
| Kupfer | Cu |
| Plutonium | Pu |
Chemische Eigenschaften und Reaktionsfähigkeit
Chemische Eigenschaften und die Reaktionsfähigkeit der Elemente basieren auf ihrer Struktur und Position im Periodensystem. Jedes Element besitzt ein individuelles Set an chemischen Eigenschaften, das durch seine Elektronenkonfiguration bestimmt wird. Die Anzahl der Protonen im Kern und die Verteilung der Elektronen beeinflussen, wie reaktionsfreudig oder stabil ein Element ist.
Ein wesentlicher Faktor dabei ist die Ionenbildung. Elemente können Elektronen abgeben oder aufnehmen, um Ionen zu bilden, was ihre Reaktivität erheblich beeinflusst. So sind Elemente der Hauptgruppen Chemie, wie die Alkalimetalle, hochreaktiv und geben leicht Elektronen ab, um stabile Ionen zu formen.
Die Edelgase hingegen sind aufgrund ihrer voll besetzten Außenschalen äußerst stabil und reagieren kaum mit anderen Stoffen. Diese Eigenschaften spiegeln sich auch in ihren Chemical symbols wider, die international anerkannt sind und in jeder wissenschaftlichen Notation Verwendung finden.
Übergangsmetalle zeigen eine interessante Vielfalt an Oxidationszuständen, was sie besonders in katalytischen Prozessen wertvoll macht. Ihre Symbole gehören ebenfalls zur grundlegenden Chemische Notationen, die weltweit genutzt werden.
Das Verständnis dieser Eigenschaften hilft Wissenschaftlern und Industriellen, diese Elemente gezielt für verschiedene Anwendungen einzusetzen. Von der medizinischen Nutzung bestimmter Metalle bis hin zur industriellen Produktion von Materialien spielen chemische Eigenschaften eine zentrale Rolle.
Biologische Rolle und Nutzen für Organismen
Die chemischen Elemente spielen eine entscheidende Rolle im Leben aller Organismen. Jedes biologisch relevante Element trägt zu spezifischen Funktionen und Prozessen innerhalb von Lebewesen bei.
Ein Beispiel ist Sauerstoff (O), der für die Zellatmung unerlässlich ist. Ohne Sauerstoff könnten Zellen keine Energie aus Nährstoffen gewinnen. Ebenso wichtig ist Kohlenstoff (C), das Grundgerüst aller organischen Moleküle wie Proteine, Lipide und Nukleinsäuren bildet.
Für den menschlichen Körper sind Spurenelemente entscheidend. Eisen (Fe) ist notwendig für den Transport von Sauerstoff im Blut durch Hämoglobin. Ein Mangel führt zu Anämie, einer Erkrankung, die durch Müdigkeit und Schwäche gekennzeichnet ist.
Andere wichtige Spurenelemente umfassen Calcium (Ca) für stärkere Knochen und Zähne sowie Magnesium (Mg), welches als Kofaktor in vielen enzymatischen Reaktionen wirkt.
Pflanzen benötigen auch verschiedene Elemente wie Stickstoff (N) und Phosphor (P). Stickstoff ist ein wesentlicher Bestandteil von Aminosäuren und Nukleotiden, während Phosphor für die Herstellung von ATP, dem Hauptenergieträger in Zellen, essentiell ist.
Zusammenfassend spielen chemische Elemente nicht nur in der Chemie, sondern auch in der Biologie eine herausragende Rolle und tragen erheblich zur Funktionalität und Gesundheit sämtlicher Organismen bei.
Industrielle Anwendungen und wirtschaftliche Relevanz
Chemische Elemente finden in unzähligen industriellen Anwendungen Verwendung und haben erhebliche wirtschaftliche Bedeutung. Eisen (Fe) beispielsweise ist ein wesentlicher Bestandteil in der Stahlproduktion, welcher die Grundlage für den Bau von Gebäuden, Brücken und Fahrzeugen bildet. Ohne Eisen und seine Legierungen wäre die moderne Infrastruktur undenkbar.
Ein weiteres Beispiel ist Silizium (Si), das in der Elektronikbranche unverzichtbar ist. Es wird zur Herstellung von Halbleitern verwendet, die in Computern, Smartphones und anderen elektronischen Geräten stecken. Silizium steht somit im Zentrum der digitalen Revolution und treibt technologischen Fortschritt voran.
Auch Edelmetalle wie Gold (Au) und Platin (Pt) spielen eine wichtige Rolle. Gold findet nicht nur in Schmuck und Münzen Verwendung, sondern auch in der Elektronikindustrie wegen seiner hervorragenden Leitfähigkeit und Korrosionsbeständigkeit. Platin wird oft als Katalysator in der chemischen Industrie eingesetzt, um wichtige chemische Reaktionen zu beschleunigen.
Aluminium (Al) ist aufgrund seiner Leichtigkeit und Widerstandsfähigkeit gegen Korrosion weit verbreitet in der Luft- und Raumfahrt sowie in der Verpackungsindustrie, insbesondere für Getränkedosen.
Die Liste der Anwendungen ist lang und erstreckt sich über viele Branchen, von Energieerzeugung und Medizintechnik bis hin zur Landwirtschaft. Chemikalien aus Elementen wie Stickstoff (N) und Phosphor (P) sind entscheidend für Düngemittel, die wiederum die landwirtschaftliche Produktivität erhöhen.
Das Periodensystem bietet eine Fülle an Möglichkeiten, jedes mit seinen einzigartigen Eigenschaften, die spezifische Industrieprozesse unterstützen und verbessern.
| Elementname | Kurzzeichen | Ordnungszahl | Entdecker |
|---|---|---|---|
| Hydrogenium | H | 1 | Henry Cavendish |
| Oxigenium | O | 8 | Joseph Priestley |
| Ferrum | Fe | 26 | Unbekannt |
| Cuprum | Cu | 29 | Unbekannt |
| Plutonium | Pu | 94 | Glenn T. Seaborg |
Besondere Gruppen von Elementen (zB Edelgase)
Besondere Gruppen von Elementen sind zum Beispiel die Edelgase, Übergangsmetalle und Alkalimetalle. Diese Gruppen weisen charakteristische chemische Eigenschaften auf, die sie von anderen Elementen unterscheiden.
Edelgase, wie Helium (He), Neon (Ne) und Argon (Ar), sind aufgrund ihrer vollen Elektronenschalen bekannt für ihre Reaktionsträgheit. Sie kommen in der Natur meist als einzelne Atome vor und gehen kaum Verbindungen mit anderen Elementen ein. Dies macht sie zu idealen Kandidaten für Anwendungen, bei denen Inertheit gefragt ist, beispielsweise zur Schaffung einer schützenden Atmosphäre bei chemischen Prozessen.
Die Übergangsmetalle, darunter Eisen (Fe), Kupfer (Cu) und Gold (Au), sind dafür bekannt, dass sie mehrere Oxidationsstufen annehmen können. Diese Fähigkeit ermöglicht es ihnen, vielschichtige Komplexe mit anderen Ionen und Molekülen zu bilden, was besonders in Bereichen wie Katalyse, Legierungen und Elektronik nützlich ist.
Alkalimetalle wie Natrium (Na) und Kalium (K) zeichnen sich durch ihre hohe Reaktivität aus, insbesondere in Verbindung mit Wasser. Diese Elemente spielen eine wichtige Rolle in biologischen Systemen, zum Beispiel im Nerven- und Muskelgewebe.
Ein weiterer erwähnenswerter Typus sind die Halogene wie Fluor (F) und Chlor (Cl). Diese Elemente sind nichtmetallisch und hochreaktiv, oft als Salzbinder genutzt. Aufgrund ihrer starken Elektronegativität finden sie vielfach Anwendung in der Chemieindustrie und Medizin.
Durch die gezielte Einordnung im Periodensystem und deren typische Chemische Symbole, hilft uns diese systematische Gruppierung dabei, ihr Verhalten vorherzusehen und sinnvoll zu nutzen.
Chemische Elemente und Umweltbelastung
Chemische Elemente spielen eine entscheidende Rolle bei Umweltbelastungen. Besonders Schwermetalle wie Blei (Pb), Quecksilber (Hg) und Kadmium (Cd) sind bekannt für ihre toxischen Eigenschaften. Solche Elemente können in erheblichen Mengen durch industrielle Aktivitäten in die Umwelt freigesetzt werden, was zu schwerwiegenden gesundheitlichen Problemen führt.Viele dieser SPEZIELLEN CHEMISCHEN NOTATIONEN haben langfristige Auswirkungen auf Ökosysteme und Organismen. Zum Beispiel kann Quecksilber über die Nahrungskette bioakkumulieren und besonders Fische betreffen, die wiederum von Menschen konsumiert werden. Auch Mikroorganismen im Boden und Wasser sind häufig betroffen, was die biologische Vielfalt beeinträchtigen kann.
Ein weiteres Problem stellt die Freisetzung von radioaktiven Elementen dar, wie etwa Uran (U) und Plutonium (Pu). Diese Elemente zerfallen langsam und setzen dabei schädliche Strahlung frei. Dies birgt ein hohes Risiko für Mensch und Natur.
NOBELGASE ABKÜRZUNGEN und andere chemische Symbole im Periodensystem bieten wichtige Hinweise zur Identifikation solcher Elemente. Da viele dieser Substanzen nicht biologisch abgebaut werden können, ist eine kontrollierte Entsorgung entscheidend. Unternehmen und Regierungen sind aufgefordert, strenge Vorschriften einzuhalten, um sicherzustellen, dass chemische Abfälle korrekt behandelt werden.
Schließlich spielen moderne Technologien eine wichtige Rolle bei der Reduzierung von Emissionen und Umweltverschmutzung. Durch die Entwicklung nachhaltiger Produktionsmethoden und den Einsatz geldsparender Techniken können wir einen bedeutenden Beitrag zum Schutz unserer Erde leisten.
Zukünftige Entwicklungen und neue Elemente
Die Forschung in der Chemie entwickelt sich ständig weiter und bringt immer wieder neue Elemente hervor. Das spiegelt sich besonders im Periodensystem wider, das fortlaufend ergänzt wird. Aktuelle Studien konzentrieren sich darauf, superschwere Elemente mit höherer Protonenzahl zu erzeugen. Diese Elemente befinden sich häufig am Ende des Periodensystems und haben äußerst kurze Halbwertszeiten.
Neue Technologien und verbesserte Instrumente ermöglichen es Wissenschaftlern, Experimente durchzuführen, die vor einigen Jahrzehnten noch undenkbar waren. Durch den Einsatz von Teilchenbeschleunigern und speziellen Detektoren konnten in den letzten Jahren mehrere neue Elemente entdeckt werden. Besondere Aufmerksamkeit gilt dabei auch den chemischen Eigenschaften dieser Elemente, da sie oft einzigartige Reaktionsmuster aufweisen könnten, die wiederum industrielle Anwendungen revolutionieren könnten.
Eine wichtige Rolle spielen internationale Kooperationen zwischen verschiedenen Forschungsinstituten und Ländern. Es gibt zahlreiche Projekte, bei denen Physiker und Chemiker gemeinsam daran arbeiten, unbekannte Bereiche des Periodensystems genauer zu untersuchen. Dabei ist es nicht nur das Ziel, neue Elemente zu entdecken, sondern auch deren Stabilität und mögliche Nutzen für verschiedene Branchen zu erforschen.
Zukünftige Entwicklungen können auch zur Bestätigung oder Widerlegung bestehender Theorien führen und unser Verständnis der Materie grundlegend verändern. Der ständige Fortschritt auf diesem Gebiet ist ein faszinierendes Beispiel dafür, wie eng Wissenschaft und Technologie miteinander verknüpft sind.