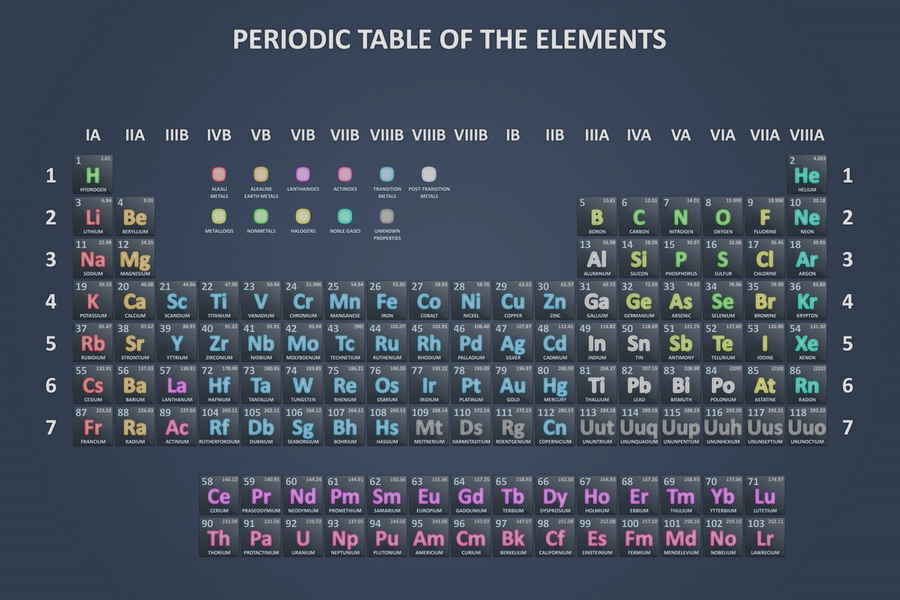
Die chemischen Elemente sind die Bausteine unserer Welt und bilden das Fundament der Chemie. Jedes einzelne Element hat einzigartige Eigenschaften und tritt in verschiedenen Zuständen auf. In dieser Liste werden alle bekannten Elemente von A bis Z, inklusive ihrer wichtigsten Merkmale und Anwendungen, vorgestellt.
Unsere Übersicht bietet nicht nur Informationen zur Atommasse und den Isotopen eines jeden Elements, sondern auch zu ihren chemischen Reaktionen und Verbindungen. Entdecken Sie die vielseitigen Nutzen und Vorkommen der einzelnen chemischen Elemente in Natur und Technik.
Das Wichtigste in Kürze
- Jedes chemische Element hat eine spezifische Atommasse und Isotope mit einzigartigen Eigenschaften.
- Elementnummer und Symbol sind essentielle Identifikatoren im Periodensystem der Elemente.
- Elemente treten in verschiedenen Zuständen auf: fest, flüssig oder gasförmig bei Raumtemperatur.
- Vielfältige Anwendungen: von Elektronik, Medizin, Bauwesen bis zu Haushaltsprodukten.
- Sicherheit und Lagerung chemischer Elemente sind entscheidend zur Vermeidung von Unfällen.
| Element | Abkürzung |
|---|---|
| Actinium | Ac |
| Aluminium | Al |
| Americium | Am |
| Antimon | Sb |
| Argon | Ar |
| Barium | Ba |
| Beryllium | Be |
| Bismut | Bi |
| Bohrium | Bh |
| Bor | B |
| Brom | Br |
| Cadmium | Cd |
| Calcium | Ca |
| Californium | Cf |
| Cer | Ce |
| Cäsium | Cs |
| Chlor | Cl |
| Chrom | Cr |
| Cobalt | Co |
| Curium | Cm |
| Darmstadtium | Ds |
| Dubnium | Db |
| Dysprosium | Dy |
| Einsteinium | Es |
| Erbium | Er |
| Europium | Eu |
| Eisen | Fe |
| Fermium | Fm |
| Flerovium | Fl |
| Fluor | F |
| Francium | Fr |
| Gadolinium | Gd |
| Gallium | Ga |
| Germanium | Ge |
| Gold | Au |
| Hafnium | Hf |
| Hassium | Hs |
| Helium | He |
| Holmium | Ho |
| Indium | In |
| Iod | I |
| Jod | I |
| Kalium | K |
| Kadmium | Cd |
| Kupfer | Cu |
| Lanthan | La |
| Lawrencium | Lr |
| Lithium | Li |
| Livermorium | Lv |
| Lutetium | Lu |
| Magnesium | Mg |
| Mangan | Mn |
| Meitnerium | Mt |
| Molybdän | Mo |
| Natrium | Na |
| Neodym | Nd |
| Neon | Ne |
| Nihonium | Nh |
| Niob | Nb |
| Nickel | Ni |
| Nihonium | Nh |
| Natrium | Na |
| Neodym | Nd |
| Nobelium | No |
| Osmium | Os |
| Phosphor | P |
| Palladium | Pd |
| Platin | Pt |
| Polonium | Po |
| Praseodym | Pr |
| Protactinium | Pa |
| Radium | Ra |
| Radon | Rn |
| Rhenium | Re |
| Rhodium | Rh |
| Rubidium | Rb |
| Ruthenium | Ru |
| Rutherfordium | Rf |
| Sauerstoff | O |
| Samarium | Sm |
| Scandium | Sc |
| Schwefel | S |
| Seaborgium | Sg |
| Selen | Se |
| Silber | Ag |
| Stickstoff | N |
| Strontium | Sr |
| Tantal | Ta |
| Technetium | Tc |
| Tellur | Te |
| Tennessin | Ts |
| Terbium | Tb |
| Thallium | Tl |
| Thorium | Th |
| Thulium | Tm |
| Titan | Ti |
| Tungsten | W |
| Uran | U |
| Vanadium | V |
| Wasserstoff | H |
| Wolfram | W |
| Xenon | Xe |
| Ytterbium | Yb |
| Yttrium | Y |
| Zink | Zn |
Elementnummer und Symbol
Bei der Elementnummer handelt es sich um die Anzahl der Protonen im Atomkern eines Elements. Diese Zahl bestimmt seinen Platz im Periodensystem und ist ein wichtiger Identifikator. Jedes Element hat eine eindeutig definierte Nummer, beginnend bei 1 für Wasserstoff bis hin zu den höheren Zahlen für schwerere Elemente.
Das Symbol eines chemischen Elements besteht aus ein oder zwei Buchstaben, wobei der erste Buchstabe stets großgeschrieben wird. Diese Symbole sind international gültig und dienen zur schnellen und eindeutigen Identifikation. Oft leiten sie sich aus dem lateinischen Namen des Elements ab. Beispielsweise steht „H“ für Wasserstoff (Hydrogenium) und „Au“ für Gold (Aurum).
Nehmen wir als Beispiel das Element Eisen mit der Elementnummer 26 und dem Symbol „Fe“. Die Nummer zeigt an, dass jedes Eisenatom 26 Protonen besitzt. Das Symbol „Fe“ stammt vom lateinischen Wort „Ferrum“.
Diese Kombination aus Nummer und Symbol ermöglicht es Wissenschaftlern auf der ganzen Welt, präzise und effizient über die verschiedenen Elemente zu kommunizieren. Sie bildet die Grundlage vieler chemischer Gleichungen und Prozesse, von schulischen Experimenten bis hin zu hochkomplexen industriellen Anwendungen.
Alles, was existiert, besteht aus kleinen Bausteinen, und in der Chemie sind diese Bausteine die Elemente. – Dmitri Mendelejew
Name des Elements
Der Name eines chemischen Elements ist von zentraler Bedeutung, da er oft historische oder wissenschaftliche Hintergründe widerspiegelt. Viele Elemente sind nach berühmten Wissenschaftlern, mythologischen Figuren oder geografischen Orten benannt.
Zum Beispiel stammt der Name „Wasserstoff“ vom griechischen Wort „Hydro“ für Wasser und dem lateinischen „genesis“ für Erzeugung, was die gasbildende Eigenschaften des Elements verdeutlicht. Ein weiteres Beispiel wäre das Element „Curium“, welches zu Ehren der bekannten Wissenschaftler Marie und Pierre Curie benannt wurde.
Darüber hinaus bieten einige Namen Hinweise auf bestimmte Eigenschaften oder physikalische Zustände des Elements. So leitet sich „Gold“ von dem altenglischen Wort ‚Geolu‘ ab, was Gelb bedeutet, wie auch die Farbe des Metalls.
Im Gegensatz dazu kommen einige modernere Namen aus dem Bereich der Hochenergiephysik. Das im Jahr 2003 entdeckte Element „Copernicium“ (Cn), benannt nach dem Astronomen Nikolaus Kopernikus, erinnert an dessen Beitrag zur Astronomie.
Zusammengefasst sind die Namen der Chemischen Elemente A-Z mehr als nur Bezeichnungen; sie erzählen Geschichten und verweben kulturelle, historische und wissenschaftliche Aspekte miteinander. Solche Details machen die Chemische Elemente A-Z besonders spannend und bemerkenswert.
| Elementnummer | Symbol |
|---|---|
| 1 | H |
| 2 | He |
| 3 | Li |
| 4 | Be |
| 5 | B |
| 6 | C |
| 7 | N |
| 8 | O |
| 9 | F |
| 10 | Ne |
Atommasse und Isotope
Die Atommassen der chemischen Elemente variieren und beziehen sich auf die durchschnittliche Masse ihrer Atome, berechnet anhand der natürlichen Isotopenhäufigkeit. Es ist wichtig zu beachten, dass die angegebene Atommasse ein Mittelwert ist und diese Masse in atomaren Masseneinheiten (u) gemessen wird. Ein Beispiel hierfür ist das Element Kohlenstoff, das eine typische Atommasse von etwa 12,01 u hat.
Isotope sind Varianten eines Elements, bei denen die Protonenzahl gleich, aber die Neutronenzahlen unterschiedlich sind. Einige Elemente haben nur ein stabiles Isotop, während andere mehrere stabile oder instabile Isotope besitzen. Instabile Isotope sind radioaktiv und können zerfallen, wobei sie Strahlung abgeben, wie es z.B. beim Isotop Kohlenstoff-14 der Fall ist.
Ein bekanntes Beispiel ist Uran, das hauptsächlich aus den Isotopen Uran-238 und Uran-235 besteht. Während Uran-238 relativ stabil ist, wird Uran-235 aufgrund seiner Fähigkeit zur Kernspaltung in Atomkraftwerken und Atomwaffen verwendet.
Jedes Isotop eines Elements besitzt leicht unterschiedliche physikalische Eigenschaften, was sie nützlich für verschiedene Anwendungen macht, einschließlich medizinischer Diagnostik und Altersdatierung in der Archäologie.
Eigenschaften und Zustände
Chemische Elemente können eine Vielzahl von Eigenschaften und Zuständen aufweisen, die ihre Einzigartigkeit ausmachen. Diese Eigenschaften reichen von physikalischen Merkmalen bis hin zu chemischem Verhalten. So haben einige Elemente metallische Eigenschaften wie Glanz, Duktilität und elektrische Leitfähigkeit, während andere nichtmetallisch sind und eher spröde und isolierend wirken.
Die Zustandsformen der Elemente sind ebenfalls vielfältig. Die meisten Metalle liegen bei Raumtemperatur in festem Zustand vor, wohingegen Gase wie Sauerstoff und Stickstoff gasförmig sind. Einige wenige Elemente, wie Quecksilber und Brom, existieren bei Zimmertemperatur als Flüssigkeiten.
Ein weiteres interessantes Merkmal ist die Reaktivität. Edelgase wie Helium und Neon sind für ihre reaktionsträge Natur bekannt, da sie stabile Elektronenkonfigurationen besitzen. Auf der anderen Seite gibt es hochreaktive Elemente wie Fluor und Natrium, die schnell und energisch mit anderen Stoffen reagieren.
Dichte, Schmelz- und Siedepunkte variieren ebenfalls stark zwischen den Elementen. Während Wolfram einen extrem hohen Schmelzpunkt hat, besitzt Wasserstoff einen sehr niedrigen. Einflüsse wie Temperatur und Druck können zudem den Zustand eines Elements verändern, was besonders im Rahmen industrieller Prozesse von Bedeutung ist.
Zusammenfassend lässt sich sagen, dass Vielfalt und spezifische Eigenschaften der chemischen Elemente entscheidend für ihren Einsatz in verschiedenen Bereichen der Technik und Wissenschaft sind.
Anwendungen und Nutzen
Chemische Elemente haben vielfältige Anwendungen und Nutzen in unterschiedlichen Bereichen. In der Elektronikindustrie wird Silizium für die Herstellung von Halbleiterschaltkreisen genutzt, während Kupfer wegen seiner hervorragenden Leiteigenschaften in Elektrokabeln zum Einsatz kommt.
In der Medizin gewinnen Radionuklide wie Technetium-99m an Bedeutung, weil sie ein wichtiger Bestandteil von Diagnoseverfahren sind. Auch Silber zeigt sich als nützlich, es findet Anwendung bei der Herstellung von Desinfektionsmitteln und antibakteriellen Beschichtungen medizinischer Geräte.
Die Bauwirtschaft verwendet Eisen zur Stahlerzeugung, das Rückgrat für zahlreiche Konstruktionsprojekte bildet. Aluminium ist durch seine Leichtigkeit und Korrosionsbeständigkeit ein bevorzugtes Material im Flugzeugbau und im Automobilsektor.
Elemente wie Schwefel spielen eine wesentliche Rolle in der Landwirtschaft; sie werden als Düngemittelkomponenten genutzt, um das Wachstum bestimmter Pflanzen zu fördern.
Auch im Haushalt finden chemische Elemente Anwendung: Natronlauge und Kalilauge sind essentielle Bestandteile vieler Reinigungsmittel, während Chlor zur Wasseraufbereitung unverzichtbar ist.
Jedes Element hat einzigartige Eigenschaften und kann so vielseitig eingesetzt werden, dass menschliche Aktivitäten auf seine Nutzung angewiesen sind. Chemische Elemente A-Z entdecken ihre spezifischen Rollen und Anwendungen überall in unserem täglichen Leben.
Vorkommen und Entdeckung
Die meisten chemischen Elemente kommen in der Natur vor, jedoch nicht immer in reiner Form. Oft sind sie in Verbindungen oder als Bestandteil von Mineralien zu finden. Zum Beispiel ist Aluminium eines der häufigsten Elemente in der Erdkruste und kommt hauptsächlich in Form von Bauxit vor.
Gold hingegen findet man eher selten und dann meist in gediegener Form. Einige Elemente, wie das Edelmetall Platin, sind sogar noch seltener und werden oft in Flussablagerungen gefunden.
Die Entdeckung vieler Elemente erfolgte häufig durch zufällige Beobachtungen oder bei der Untersuchung bereits bekannter Substanzen. So wurde Phosphor im Jahr 1669 entdeckt, als der Alchemist Hennig Brand bei dem Versuch Gold aus Urin zu gewinnen, einen leuchtenden Stoff fand.
Die Methoden zur Entdeckung neuer Elemente haben sich im Laufe der Zeit erheblich weiterentwickelt. Heute verwenden Wissenschaftler fortschrittliche Techniken wie die Massenspektrometrie und Röntgenkristallographie, um neue Elemente zu identifizieren.
Es gibt auch Elemente, die nur künstlich hergestellt wurden, indem Atomkerne beschossen und verschmolzen werden. Solche synthetischen Elemente sind oft instabil und zerfallen schnell, was ihre Untersuchung erschwert. Jedoch hat ihre Herstellung erheblich zum Verständnis der Kernphysik beigetragen.
Reaktionen und Verbindungen
Chemische Elemente A-Z erstrecken sich über ein breit gefächertes Spektrum an Reaktionen und Verbindungen. Die chemischen Eigenschaften eines Elements diktieren die Art der Bindungen, die es eingehen kann. Diese sind oftmals maßgeblich für den Einsatz des Elements in verschiedenen Industrien.
Metalle beispielsweise reagieren häufig mit Nichtmetallen und bilden dabei Kationen, die in ionischen Verbindungen wie Salzen vorkommen. Typisch ist die Reaktion von Natrium (Na) mit Chlor (Cl), wobei das gut bekannte Kochsalz (Natriumchlorid) entsteht. Solche Prozesse spielen eine zentrale Rolle in der Chemie und Industrie.
Nichtmetalle neigen dazu, kovalente Bindungen zu formen. Ein bekanntes Beispiel ist die Bildung von Wasser (H₂O) durch die Reaktion von Wasserstoff (H) mit Sauerstoff (O). Diese Verbindung ist wohl eine der bedeutendsten in unserem täglichen Leben und bildet viele physikalische und chemische Prozesse ab.
Elemente aus derselben Gruppe im Periodensystem zeigen oft ähnliche Reaktionen. Dies liegt daran, dass sie vergleichbare äußere Elektronenanordnungen haben, was ihre Chemie bestimmt. Zum Beispiel reagieren die Halogene (Fluor, Chlor, Brom, Iod) alle auf ähnliche Weise mit Metallen zur Bildung von Halogeniden.
Darüber hinaus sind einige Elemente sehr reaktiv, während andere inert bleiben. Edelmetalle wie Gold (Au) und Platin (Pt) zeichnen sich durch ihre geringe Reaktivität aus und werden oft in Schmuck oder als Katalysatoren verwendet.
Zusammenfassend lässt sich sagen, dass die Reaktivität und die Verbindungen chemischer Elemente nicht nur faszinierend, sondern auch essenziell für viele Anwendungen sind.
Sicherheit und Lagerung
Die Sicherheit und Lagerung chemischer Elemente ist von größter Bedeutung, um Unfälle und gesundheitliche Risiken zu vermeiden. Einige Elemente sind hochreaktiv oder giftig und erfordern spezielle Vorkehrungen. Beispielsweise sollten Alkali- und Erdalkalimetalle wie Natrium und Kalium in inerten Atmosphären oder unter einer Schicht von Paraffinöl aufbewahrt werden, da sie stark mit Wasser reagieren.
Viele Metalle oxidieren ebenfalls leicht und müssen daher in Luftdichten Behältern gelagert werden. Phosphor beispielsweise kann sich bei Kontakt mit der Umwelt selbst entzünden und muss daher unter Wasser oder in einem dichten Behälter aufbewahrt werden. Hochgiftige Stoffe wie Quecksilber und Beryllium stellen erhebliche Gesundheitsrisiken dar und sollten nur unter strengen Sicherheitsmaßnahmen gehandhabt werden.
Für die Lagerung von Gasen kommen meist Druckbehälter zum Einsatz. Diese müssen regelmäßig überprüft werden, um Lecks zu verhindern. Für den Umgang mit radioaktiven Elementen wie Uran oder Plutonium ist eine abschirmende Lagerung erforderlich, oft innerhalb spezieller Sicherheitskammern und Aufbewahrungsräume.
Generell gilt: Chemische Elemente sollten immer in klar beschrifteten Behältern aufbewahrt werden, um Verwechslungen zu vermeiden. Die Kenntnis darüber, welche Bedingungen notwendig sind, hilft dabei, ihre sicheren Eigenschaften zu gewährleisten und mögliche Gefahren zu minimieren.