Löst sich Salz in Wasser auf?
Salz löst sich in Wasser aufgrund der spezifischen chemischen und physikalischen Eigenschaften beider Substanzen. Natriumchlorid, das gängigste Speisesalz, besteht aus einer Ionischen Verbindung zwischen Natrium- (Na+) und Chloridionen (Cl–). Diese Ionenbindung ist stark, doch wenn das Salz in einem Glas Wasser landet, beginnen die Wassermoleküle ihre Arbeit.
Wasser ist ein polares Molekül, was bedeutet, dass es eine ungleiche Ladungsverteilung aufweist. Die positiven Wasserstoffatome des Wassers ziehen die negativen Chloridionen an, während die negativen Sauerstoffatome die positiven Natriumionen umhüllen. Dieser Prozess der Ion-Dipol-Wechselwirkungen führt zur Solvatation oder genauer gesagt zur Hydratation der Ionen.
Durch diese Umhüllung durch Wassermoleküle, wird die ursprüngliche Gitterenergie des Salzes überwunden. Dies resultiert in einer Lösung, in der die Ionen frei schwimmen können. Lösungsprozesse wie diese sind ein faszinierendes Beispiel für die Wechselwirkungen auf molekularer Ebene und zeigen, wie die starken Bindungen im festen Zustand durch die solvativen Effekte im Flüssigen überwunden werden können.
Das Wichtigste in Kürze
- Salz (NaCl) löst sich in Wasser durch ionische Verbindungen und Polarität.
- Wasser ist ein polares Molekül und bildet Wasserstoffbrücken.
- Positive Natriumionen ziehen negative Sauerstoffatome an.
- Negative Chloridionen ziehen positive Wasserstoffatome an.
- Ion-Dipol-Kräfte überwinden die Ionengitterkraft, führen zur Lösung.
Salz löst sich in Wasser aufgrund seiner ionischen Natur. Die Natrium- und Chloridionen des Salzes werden von den Wassermolekülen angezogen und umgeben, was zu ihrer Trennung führt. Dieser Prozess wird als Dissoziation bezeichnet, bei der die positiv geladenen Natriumionen von den negativ geladenen Chloridionen getrennt werden und von den Wassermolekülen umgeben sind. Durch diesen Vorgang bildet sich eine homogene Lösung, in der die Salzionen gleichmäßig im Wasser verteilt sind.
Beispiele für die Löslichkeitn von Salzen in Wasser
| Salz | Löslichkeit in Wasser |
|---|---|
| Natriumchlorid | Sehr gut löslich |
| Kaliumnitrat | Relativ gut löslich |
| Calciumcarbonat | Kaum löslich |
| Kaliumchlorid | Gut löslich |
| Natriumcarbonat | Sehr gut löslich |
| Magnesiumsulfat | Gut löslich |
| Ammoniumchlorid | Gut löslich |
| Silberchlorid | Kaum löslich |
| Natriumacetat | Gut löslich |
| Kaliumcarbonat | Kaum löslich |
| Eisen(III)-chlorid | Gut löslich |
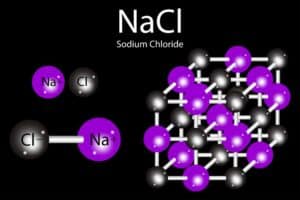
Salz besteht aus positiv und negativ geladenen Ionen
Salz besteht aus positiv und negativ geladenen Ionen. Nehmen Sie zum Beispiel Natriumchlorid (NaCl), das typische Kochsalz. In seinem festen Zustand bildet es eine Kristallstruktur, in der die Natriumionen (Na+) und Chloridionen (Cl–) durch elektrostatische Kräfte aneinander gebunden sind. Diese Kräfte werden auch als Ionenbindung bezeichnet.
Der Grund, warum Natriumchlorid sich in Wasser leicht löst, liegt in seiner ionischen Natur und den Wechselwirkungen, die zwischen den Salzionen und den Wassermolekülen auftreten. Ein solches Ionengitter ist stark, aber nicht unüberwindbar, besonders wenn ein polares Lösungsmittel wie Wasser ins Spiel kommt.
Wasser selbst ist ein polares Molekül mit einem deutlichen Dipolmoment. Die Elektronegativität von Sauerstoff zieht die Elektronen näher zu sich heran, wodurch eine partielle negative Ladung am Sauerstoffatom entsteht und positive Ladungen an den beiden Wasserstoffatomen verbleiben. Dieses Phänomen macht Wasser besonders effektiv bei der Solvatation oder Hydratation von Ionen in Salzen.
In wässrigen Lösungen umgeben die Wassermoleküle die einzelnen Ionen, reduzieren die Gitterenergie des Salzes und tragen damit zur Auflösung bei. Dieser Vorgang wird durch die Molekülwechselwirkung von Wasser und Salz getragen.
Das Geheimnis der Chemie beruht in den Wechselwirkungen auf molekularer Ebene, die wir oft erst wahrnehmen, wenn etwas so Alltägliches wie Salz sich in Wasser auflöst. – Marie Curie
| Begriff | Beschreibung |
|---|---|
| Natriumchlorid (NaCl) | Eine ionische Verbindung, die aus positiv geladenen Natriumionen (Na+) und negativ geladenen Chloridionen (Cl–) besteht. |
| Ionenbindung | Eine chemische Bindung, die durch elektrostatische Anziehung zwischen positiv und negativ geladenen Ionen entsteht. |
| Polares Molekül | Ein Molekül mit einer ungleichen Ladungsverteilung, was zu einem Dipolmoment führt, wie es bei Wasser (H2O) der Fall ist. |
| Hydratation | Der Prozess, bei dem Wassermoleküle Ionen umhüllen und dadurch die Gitterenergie überwinden, um eine Lösung zu bilden. |
| Gitterenergie | Die Energie, die aufgewendet werden muss, um die Ionen aus dem Kristallgitter eines Salzes zu entfernen. |
| Lösung | Ein homogenes Gemisch, in dem Ionen oder Moleküle in einem Lösungsmittel, wie Wasser, gleichmäßig verteilt sind. |
Wasser ist ein polares Molekül
Wasser ist ein äußerst faszinierendes Molekül. Es handelt sich hierbei um ein polares Molekül, was bedeutet, dass es aufgrund seiner Struktur und der unterschiedlichen Elektronegativität seiner Atome eine ungleiche Verteilung elektrischer Ladungen aufweist.
Ein Wassermolekül besteht aus zwei Wasserstoffatomen, die an ein Sauerstoffatom gebunden sind. Das Sauerstoffatom hat eine höhere Elektronegativität als die Wasserstoffatome, wodurch es die bindenden Elektronen stärker zu sich zieht. Dies führt dazu, dass das Ende des Moleküls, an dem die Wasserstoffatome sitzen, leicht positiv geladen ist, während das Sauerstoffende leicht negativ geladen ist.
Diese Aufteilung der Ladung nennt man ein Dipolmoment. Aufgrund dieses Dipolmoments können Wassermoleküle untereinander starke Wechselwirkungen eingehen, die als Wasserstoffbrückenbindungen bekannt sind. Diese Bindungen sind relativ stark im Vergleich zu anderen intermolekularen Kräften und tragen erheblich zur Stabilität und den einzigartigen Eigenschaften von Wasser bei.
Die Polarität des Wassers macht es zu einem ausgezeichneten Lösungsmittel für viele Substanzen, insbesondere solche mit ionischen oder polaren Charakteristika. Beim Lösen von Salz in Wasser spielen diese positiven und negativen Pole eine entscheidende Rolle. Die positiven Natriumionen (Na+) im Salz werden von den negativen Sauerstoffatomen angezogen, während die negativen Chloridionen (Cl–) durch die positiven Wasserstoffatome des Wassers angezogen werden.
Eine solch detaillierte Betrachtung der molekularen Strukturen und Wechselwirkungen dient dazu, besser zu verstehen, warum Stoffe wie Salz (Natriumchlorid) so gut in Wasser löslich sind und welche chemischen Prinzipien dahinterstecken.
Positive Natriumionen ziehen negative Sauerstoffatome an
Positive Natriumionen (Na+) ziehen negative Sauerstoffatome im Wassermolekül an. Diese Wechselwirkung spielt eine entscheidende Rolle beim Lösen von Salz in Wasser. Ein Wassermolekül besteht aus zwei Wasserstoffatomen und einem Sauerstoffatom, wobei der Sauerstoff aufgrund seiner hohen Elektronegativität eine leicht negative Ladung aufweist, während die Wasserstoffatome eine leicht positive Ladung tragen. Dieses Phänomen wird als Dipolmoment bezeichnet.
Das positiv geladene Natriumion wird von dem negativ geladenen Sauerstoffatom des Wassermoleküls angezogen. Die thermodynamisch günstige Verbindung zwischen den Na+-Ionen und den Sauerstoffatomen führt zu einer Stabilisierung der wässrigen Lösung. Solche Molekülwechselwirkungen sind auch als solvatation oder hydratisierung bekannt.
Wenn viele solcher Interaktionen zwischen Ionen und Wassermolekülen stattfinden, werden diese Ionen effektiv aus dem Ionengitter des Salzes herausgelöst und gleichmäßig im Wasser verteilt. Dies ist ein Hauptaspekt der Lösungenchemie, bei der Solvatationsenergie die Gitterenergie des Gebilden übersteigt. So bieten Wasserstoffbrückenbindungen der Wassermoleküle stabilisierenden Rückhalt für gelöste Ionen und ermöglichen es Salzen wie Natriumchlorid, sich in polarem Lösungsmittel aufzulösen.
Bei physikalischen Prozessen im wässrigen Medium spielen solche chemischen Reaktionen eine wesentliche Rolle und zeigen eindrucksvoll, dass die Kombination von molekularen Kräften zur Auflösung fester Substanzen führt. Aufgrund dieser Effekte können ionische Verbindungen wie Kochsalz ihre Kristallstruktur verlassen und vollständig in einer homogenen Flüssigkeitslösung integriert werden.
Negative Chloridionen ziehen positive Wasserstoffatome an
Negative Chloridionen ziehen positive Wasserstoffatome der Wassermoleküle an. Das Wassermolekül ist ein polares Molekül, wobei das Sauerstoffatom eine höhere Elektronegativität als die beiden Wasserstoffatome besitzt. Dies führt zu einer ungleichen Verteilung der elektrischen Ladung und erzeugt ein Dipolmoment.
Wenn Kochsalz (Natriumchlorid) in Wasser aufgelöst wird, zerfällt es in seine einzelnen Ionen – Na⁺ (positive Natriumionen) und Cl⁻ (negative Chloridionen). Die negativen Chloridionen werden von den positiven Enden der Wassermoleküle angezogen, speziell von den Wasserstoffatomen, da diese eine teilweise positive Ladung tragen. Dieser Vorgang spielt eine zentrale Rolle bei der Auflösung des Salzes im Wasser.
Die Anziehungskraft zwischen Chloridionen und den positiv geladenen Teilen der Wassermoleküle unterstützt die Hydratation, auch Solvatation genannt, der Ionen. Dabei umgeben Wassermoleküle die Ionen und stabilisieren sie in Lösung. Diese Wechselwirkung ist so stark, dass sie die Gitterenergie der Kristallstruktur von Natriumchlorid überwinden kann.
Während diese Wechselwirkungen stattfinden, lösen sich die Ionen aus dem Kristallgitter, wodurch sie letztlich zur Bildung einer homogenen Lösung beitragen. Hier spielen sowohl die Wasserstoffbrückenbindung als auch die allgemeine Molekülwechselwirkung eine wesentliche Rolle. Die Fähigkeit eines polaren Lösungsmittels wie Wasser, ionische Verbindungen wie Natriumchlorid effektiv zu lösen, hängt eng mit diesen Eigenschaften zusammen.
Das Zusammenspiel von Ion-Dipol-Kräften sowie die Solvatations- oder Hydratationsenergie sind entscheidende Mechanismen bei diesem Prozess.
Ionen werden durch Wassermoleküle umhüllt
Wenn Salz, wie Natriumchlorid (NaCl), in Wasser gelöst wird, erleben die Salzionen einen chemischen Prozess namens Solvatation und speziell Hydratation, wenn Wasser als Lösungsmittel wirkt. Dabei werden die einzelnen Ionen im Kristallgitter von Wassermolekülen umhüllt.
Das Wassermolekül hat eine besondere Eigenschaft: Es ist ein polares Molekül. Dies bedeutet, dass ein Ende des Moleküls positiv geladen ist, während das andere Ende negativ geladen ist. Durch diese Polarität wird der negative Teil des Wassermoleküls durch die positiven Natriumionen angezogen, und der positive Teil des Wassermoleküls wird durch die negativen Chloridionen angezogen.
Während dieses Prozesses überwiegen die Kräfte der Molekülwechselwirkung zwischen den Wassermolekülen und den Ionen über die ursprünglichen Ionenbindungen im Salz. Die ionischen Verbindungen werden aufgebrochen und die Ionengitterstruktur wird überwunden, was letztendlich dazu führt, dass das Salz sich vollständig in der Lösung auflöst.
Die dabei entstandene wässrige Lösung enthält nun freibewegliche Ionen, die elektrisch leitfähig sind. Diese Auflösung ist auch temperaturabhängig; bei höheren Temperaturen bewegen sich die Wassermoleküle schneller, wodurch sie effektiver mit den Ionen reagieren können.
Diesen gesamten Vorgang steuern also die beiden energiebestimmenden Faktoren: Gitterenergie und Solvatationsenergie. Während die Gitterenergie die Stabilität des Ionenkristalls beschreibt, bezieht sich die Solvatationsenergie auf die Energiefreisetzung beim Umhüllen der Ionen durch Wassermoleküle.
Der Prozess zeigt deutlich, warum Wasser als polares Lösungsmittel so effektiv bei der Auflösung ionischer Verbindungen wie Natriumchlorid fungiert: Dank seiner starken Dipolmomentes und Fähigkeit zur Ausbildung von Wasserstoffbrückenbindungen.
| Begriff | Prozess | Beschreibung |
|---|---|---|
| Natriumion (Na+) | Hydratation | Das positive Ion wird von den negativen Sauerstoffatomen der Wassermoleküle umhüllt. |
| Chloridion (Cl-) | Hydratation | Das negative Ion wird von den positiven Wasserstoffatomen der Wassermoleküle umhüllt. |
| Wasserstoffbrückenbindung | Lösen | Eine starke intermolekulare Kraft, die zwischen Wassermolekülen ausgebildet wird und die Auflösung von Salzen unterstützt. |
Ion-Dipol-Kräfte überwinden die Ionengitterkraft
Um zu verstehen, warum sich Salz in Wasser löst, ist es wichtig zu wissen, wie die Kräfte zwischen den Teilchen funktionieren. Salz, oder genauer gesagt Natriumchlorid (NaCl), besteht aus Natrium- und Chloridionen, die durch eine starke Ionenbindung zusammengehalten werden.
Wasser wiederum ist ein polares Lösungsmittel mit einem starken Dipolmoment. Das bedeutet, dass das Wassermolekül einen positiven und einen negativen Pol aufweist. Diese Eigenschaft ermöglicht spezielle Wechselwirkungen zwischen den Wassermolekülen und den Ionen im Salz.
Wenn Natriumchlorid in Kontakt mit Wasser kommt, beginnen die Ion-Dipol-Kräfte zu wirken. Das positiv geladene Natriumion zieht dabei das negative Ende des Wasser-Moleküls an, während das negativ geladene Chloridion das positive Ende der Wassermoleküle anzieht. Diese Molekülwechselwirkung führt dazu, dass die Ionen von den Wassermolekülen umhüllt werden. Dieser Vorgang wird als Solvatation oder speziell bei Wasser als Hydratation bezeichnet.
Die Energie, die freigesetzt wird, wenn diese neuen Wechselwirkungen entstehen, wird Solvatationsenergie genannt. Wenn die Solvatationsenergie groß genug ist, kann sie die Gitterenergie überwinden, die die Ionen im festen Zustand zusammenhält. In dieser Phase spricht man oft von einer Auflösung oder von Lösen, da die Ionenkristalle auseinanderfallen und in die wässrige Lösung übergehen.
Diese Prozesse verdeutlichen, warum Ion-Dipol-Kräfte stark genug sind, um die Ionengitterkraft zu überwinden und somit das Salz effektiv im Wasser zu lösen.
Ionen gelangen in wässrige Lösung
Wenn Salz wie Natriumchlorid in Wasser gelöst wird, führen die Interaktionen zwischen den Wassermolekülen und den Ionen dazu, dass diese sich lösen. Das Wassermolekül ist ein polares Molekül mit einem positiven Dipolmoment am Wasserstoff und einem negativen am Sauerstoffatom.
Zuerst zieht das positive Natriumion die negativen Bereiche der Wassermoleküle an, während das negative Chloridion die positiven Bereiche der Wassermoleküle anzieht. Dieser Prozess nennt sich Solvatation, spezifisch für Wasser als Medium heißt es Hydratation.
Während dieser Wechselwirkung werden die Ionen von den Wassermolekülen umhüllt. Diese Umhüllung oder Hydratisierung verringert die elektrostatischen Anziehungskräfte zwischen den entgegengesetzt geladenen Ionen im Kristallgitter des Salzes. Dadurch wird die Struktur des Ionengitters destabilisiert und schließlich aufgelöst.
Die Molekülwechselwirkungen zwischen den hydratisierten Ionen und dem umgebenden Wasser sind stärker als die Gitterenergie des festen Salzes, sodass die Ionen in die Lösung entweichen können. Dies beschreibt die chemische Reaktion des Lösevorgangs.
Somit führt die Kombination aus hoher Solvatationsenergie und geringer werdender Gitterenergie zur vollständigen Auflösung des Salzkristalls im Wasser. Die Einbindung der Ionen in der wässrigen Lösung veranschaulicht die Löslichkeit ionischer Verbindungen in polarer Umgebung sehr gut.
Löslichkeit ist temperaturabhängig
Löslichkeit ist temperaturabhängig. Wenn Salz in Wasser gelöst wird, spielen sowohl die Gitterenergie des Salzkristalls als auch die Solvatationsenergie eine Rolle.
Die Temperatur beeinflusst diese Energien und damit die Löslichkeit direkt. Eine höhere Temperatur bedeutet oft, dass mehr thermische Energie zur Verfügung steht, um die Ionen im Kristallgitter zu lösen. Dies kann die Ionische Verbindung schneller aufbrechen und die Hydratation der einzelnen Ionen begünstigen.
Berücksichtigt man Natriumchlorid (Kochsalz), zeigt sich, dass das Salz bei höherer Temperatur leichter im Wasser löslich ist. Das liegt daran, dass die Molekülbewegung intensiver wird, was die Wahrscheinlichkeit erhöht, dass Wassermoleküle mit dem Salz interagieren und es lösen.
Des Weiteren bedeutet eine höhere Temperatur, dass mehr Wassermoleküle die nötige Energie aufweisen, um die ionischen Bindungen innerhalb des Salzes zu unterbrechen und dadurch den Prozess der Löslichkeit zu fördern.
Zu beachten ist jedoch auch, dass nicht alle Salze von einer Temperaturänderung gleich profitieren, da die spezifischen chemischen Eigenschaften eines Salzes ebenfalls bestimmen, wie sehr seine Löslichkeit durch Temperatur beeinflusst wird. Hydratisierung und andere Molekülwechselwirkungen bleiben weiter wichtige Elemente beim Verständnis dieses Prozesses.
Die Löslichkeit von Salz in Wasser ist temperaturabhängig. Generell gilt, dass die Löslichkeit von Salz mit steigender Temperatur zunimmt. Das bedeutet, dass bei höheren Temperaturen mehr Salz in Wasser gelöst werden kann.
Alltagsbeispiele
Einige Beispiele von Salzlösungen in Wasser im Alltag sind:
- Meerwasser
- Kochsalzlösung zur Reinigung von Wunden
- Salzwasser für das Kochen von Nudeln oder Kartoffeln
- Sportgetränke mit Elektrolyten
- Konserven in Salzlake
- Solebäder zur Entspannung und Hautpflege