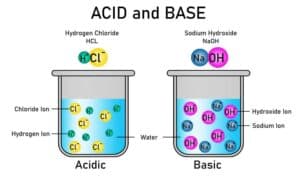
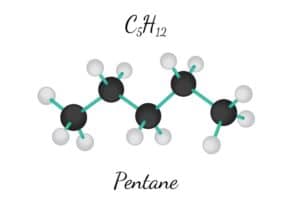
Was ist ein Molekül in der Chemie?
Die Chemie befasst sich maßgeblich mit der Untersuchung und dem Verständnis von Molekülen. Diese bestehen aus zwei oder mehr Atomen, die durch chemische Bindungen zusammengehalten werden. Über ihre Zusammensetzung hinaus beeinflusst die spezifische Molekülstruktur die physikalischen und chemischen Eigenschaften eines Stoffes.
Moleküle können sowohl in der organischen als auch in der anorganischen Chemie vorkommen. Während organische Moleküle Kohlenstoff enthalten, umfassen anorganische Moleküle eine Vielzahl anderer Elemente. Die Wechselwirkungen zwischen den Molekülen spielen eine entscheidende Rolle bei chemischen Reaktionen und bestimmen die Stabilität und Reaktivität der Verbindungen.
Verschiedene Methoden zur Analyse von Molekülen ermöglichen es Wissenschaftlerinnen und Wissenschaftlern, deren Struktur und Verhalten zu erforschen. Dazu zählen Techniken wie die molekulare Spektroskopie und die Verwendung von Molekülmodellen. Die detaillierte Untersuchung und Manipulation von Molekülen führen zu Fortschritten in zahlreichen Industrien und biologischen Anwendungen.
Das Wichtigste in Kürze
- Moleküle bestehen aus Atomen, die durch chemische Bindungen wie kovalente Bindungen zusammengehalten werden.
- Die Molekülstruktur beeinflusst stark die physikalischen und chemischen Eigenschaften eines Stoffes.
- Organische Moleküle enthalten Kohlenstoff, während anorganische Moleküle verschiedene andere Elemente umfassen.
- Methoden wie molekulare Spektroskopie und NMR-Spektroskopie analysieren detailliert die Struktur von Molekülen.
- Moleküle haben wichtige Anwendungen in Pharmaindustrie, Kunststoffen, Lebensmitteln und Energiebranchen.
Ein Molekül in der Chemie ist die kleinste Einheit einer chemischen Verbindung, die aus zwei oder mehr Atomen besteht, die durch chemische Bindungen miteinander verbunden sind. Moleküle können aus Atomen desselben Elements (wie Sauerstoff O2) oder unterschiedlicher Elemente (wie Wasser H2O) bestehen. Die Struktur eines Moleküls wird durch die Anordnung und die Art der Bindungen zwischen den Atomen bestimmt, was seine chemischen und physikalischen Eigenschaften beeinflusst.
Definition und Eigenschaften eines Moleküls
Ein Molekül ist eine Gruppe von zwei oder mehr Atomen, die durch chemische Bindungen zusammengehalten werden. Es stellt die kleinste Einheit einer chemischen Verbindung dar und besitzt spezifische Eigenschaften, die aus der Kombination und Anordnung seiner Atome resultieren. Die Molekülstruktur spielt eine entscheidende Rolle bei den physikalischen und chemischen Eigenschaften des Moleküls.
Die Atome in einem Molekül sind durch verschiedene Arten von Bindungen verbunden. Die häufigsten sind kovalente Bindungen, bei denen Atome Elektronenpaare teilen. Dies führt zur Bildung stabiler Verbindungen mit charakteristischer molekularer Geometrie. Weitere Bindungstypen umfassen ionische Bindungen und metallische Bindungen, obwohl diese weniger häufig in isolierten Molekülen vorkommen.
Moleküle können auch unterschiedliche Größen haben, was sich auf ihr Molekulargewicht niederschlägt. Das Gewicht eines Moleküls wird durch die Summe der atomaren Massen seiner Bestandteile bestimmt. Dieses ist ein wichtiger Faktor für seine physikalischen Eigenschaften wie den Siedepunkt und Schmelzpunkt.
Die Polarität eines Moleküls beeinflusst dessen intermolekulare Kräfte und damit seine Löslichkeit und Reaktivität. So führen asymmetrische Ladungsverteilungen zu Dipol-Dipol-Wechselwirkungen oder Wasserstoffbrückenbindungen zwischen Molekülen. Diese Effekte sind besonders relevant in der Chemie polarer Lösungsmittel und Biochemie.
Zusätzlich spielen Resonanzstrukturen eine wichtige Rolle; sie beschreiben delokalisierte Elektronen innerhalb des Moleküls, die unterschiedlich verteilte Bindungscharakteristika vermitteln können. Dadurch erhalten manche Moleküle erhöhte Stabilität und unterschiedliche chemische Reaktivitäten, je nach Umweltbedingungen.
„Die Chemie ist die Lehre von den Zuständen und Umwandlungen der Stoffe; sie befasst sich mit der Erkenntnis der Zusammensetzung der Körper und den Gesetzen, nach denen sich die Stoffe ineinander umwandeln.“
– Justus von Liebig
| Begriff | Beschreibung |
|---|---|
| Molekülstruktur | Die spezifische Anordnung der Atome in einem Molekül, die dessen Eigenschaften beeinflusst. |
| chemische Bindungen | Kräfte, die Atome in einem Molekül zusammenhalten, z.B. kovalente Bindungen. |
| Atome und Moleküle | Grundlegende Bausteine der Materie; Atome bilden durch chemische Bindungen Moleküle. |
| Molekulargewicht | Das Gewicht eines Moleküls, bestimmt durch die Summe der atomaren Massen seiner Atome. |
| chemische Reaktionen | Prozesse, bei denen Moleküle ihre Struktur ändern, neue Bindungen bilden oder gespalten werden. |
| kovalente Bindungen | Bindungen, bei denen Atome Elektronenpaare teilen, um stabile Moleküle zu bilden. |
| molekulare Geometrie | Die dreidimensionale Anordnung von Atomen in einem Molekül. |
| Molekülmodelle | Visuelle oder physikalische Darstellungen von Molekülen zur besseren Verständnis ihrer Struktur. |
| chemische Formeln | Symbolische Darstellungen von Molekülen, die die Art und Anzahl der Atome angeben. |
| intermolekulare Kräfte | Kräfte, die Wechselwirkungen zwischen verschiedenen Molekülen beschreiben, z.B. Wasserstoffbrückenbindungen. |
Chemische Bindungen und Molekülstruktur
Atome und Moleküle bilden stabile Verbindungen durch chemische Bindungen. Es gibt verschiedene Arten von chemischen Bindungen, darunter kovalente Bindungen, ionische Bindungen und Metallbindungen. Bei der kovalenten Bindung teilen sich die Atome Elektronenpaare, um eine stabilere elektronische Konfiguration zu erreichen.
Die Polarität von Molekülen hängt stark von der Art der Bindung und der molekularen Geometrie ab. Die VSEPR Theorie (Valence Shell Electron Pair Repulsion) hilft bei der Vorhersage der räumlichen Anordnung von Atomen in einem Molekül, indem sie berücksichtigt, wie sich Elektronenpaare gegenseitig abstoßen. Diese Theorie ist entscheidend für das Verständnis der molekularen Form und Eigenschaften.
Eine besondere Rolle spielen auch Wasserstoffbrückenbindungen. Obwohl sie schwächer als kovalente Bindungen sind, tragen sie erheblich zur Stabilität und Struktur vieler biologischer Moleküle, wie zum Beispiel DNA und Proteine, bei.
Resonanzstrukturen sind ein weiteres Konzept, das verwendet wird, um bestimmte Molekülstrukturen darzustellen, bei denen die Elektronenverteilung zwischen verschiedenen Atomanordnungen variiert. Diese Strukturen sind insbesondere bei organischen Molekülen wichtig.
Durch die Kombination von Chemie und Quantenmechanik ermöglicht die Molekülorbitaltheorie eine tiefere Einsicht in die Bildung und Eigenheiten von Molekülen. Molekülorbitale entstehen aus der Überlappung atomarer Orbitale und können bindend oder antibindend sein, was die Gesamtstabilität des Moleküls beeinflusst.
Moleküle in organischer und anorganischer Chemie
Die Chemie unterscheidet zwischen organischen und anorganischen Molekülen, basierend auf ihrer Zusammensetzung und Struktur. Organische Moleküle enthalten primär Kohlenstoff und Wasserstoff, oftmals in Verbindung mit Sauerstoff, Stickstoff und anderen Elementen. Beispiele dafür sind Proteine, Fette und Kohlenhydrate.
Anorganische Moleküle hingegen bestehen aus einer Vielzahl von Elementen, darunter Metalle und Nichtmetalle. Diese Moleküle können einfache Verbindungen wie Kochsalz (NaCl) oder komplexere Strukturen wie Metallkomplexe umfassen.
Ein zentrales Merkmal der organischen Chemie ist die Vielfalt der kovalenten Bindungen zwischen Kohlenstoffatomen, die zu unterschiedlichen Ketten- oder Ringstrukturen führen. Solche Strukturen werden oft durch die Resonanzstrukturen veranschaulicht, die die Delokalisierung von Elektronen innerhalb eines Moleküls darstellen.
Im Gegensatz dazu spielen in der anorganischen Chemie intermolekulare Kräfte eine größere Rolle, wie Wasserstoffbrückenbindungen und ionische Wechselwirkungen. Diese bestimmen wichtige Eigenschaften wie Schmelz- und Siedepunkte sowie die Löslichkeit.
Chemische Reaktionen in beiden Bereichen folgen den gleichen Grundprinzipien, dennoch unterscheiden sich die Mechanismen und Resultate oft erheblich. Während organische Reaktionen häufig aufgrund der Molekülstruktur spezifisch sind, zeigen anorganische Reaktionen oft eine breitere Palette an Möglichkeiten und Produkttypen.
Zusammengefasst, bietet die Einteilung in organische und anorganische Moleküle wertvolle Perspektiven zur Klassifikation und Analyse chemischer Substanzen und deren Verhalten in verschiedenen Reaktionen.
Reaktionen und Verbindungen zwischen Molekülen
Atome und Moleküle interagieren auf vielfältige Weise miteinander und können dabei unterschiedliche Verbindungen eingehen. Diese chemischen Reaktionen sind grundlegend für das Verständnis der Chemie. Eine der häufigsten Formen chemischer Bindungen ist die kovalente Bindung, bei der zwei Atome Elektronenpaare teilen, um stabile Moleküle zu bilden.
Die molekulare Geometrie spielt ebenfalls eine entscheidende Rolle. Die Anordnung der Atome im Raum beeinflusst die Eigenschaften und das Verhalten eines Moleküls in einer Reaktion. Dies kann mithilfe von Modellen wie der VSEPR Theorie (Valence Shell Electron Pair Repulsion) vorhergesagt werden, die beschreibt, wie sich Elektronenpaarbindungen um ein Atom anordnen.
Ein weiterer wichtiger Aspekt sind intermolekulare Kräfte, wie Wasserstoffbrückenbindungen. Diese schwächeren Bindungen bestimmen viele physikalische Eigenschaften von Substanzen, etwa Schmelz- und Siedepunkte.
Resonanzstrukturen sind ebenfalls relevant. Sie zeigen die Möglichkeit mehrerer korrekter Strukturformeln für ein einzelnes Molekül und geben Hinweise auf die Stabilität des Moleküls.
Bei chemischen Reaktionen müssen wir auch auf die Polarität von Molekülen achten. Polare Moleküle haben ungleiche Ladungsverteilungen, was ihre Fähigkeit zur Wechselwirkung mit anderen Molekülen beeinflusst.
Insgesamt sind chemische Reaktionen zwischen Molekülen vielschichtig und durch zahlreiche Faktoren wie Molekulargewicht, chemische Formeln und die spezifische Molekülstruktur charakterisiert.
Methoden zur Analyse von Molekülen
Zur Analyse von Molekülen stehen verschiedene Methoden zur Verfügung, die detaillierte Einblicke in deren Struktur und Eigenschaften ermöglichen. Eine der am häufigsten verwendeten Techniken ist die molekulare Spektroskopie, bei der die Wechselwirkungen zwischen elektromagnetischer Strahlung und Molekülen untersucht werden.
Eine weitere wichtige Methode ist die Kernspinresonanzspektroskopie (NMR-Spektroskopie), die Informationen über die chemische Umgebung von Atomkernen liefert. Dabei spielen Elektronenpaarbindungen eine wesentliche Rolle, da sie den Einfluss auf benachbarte Atome und dadurch auf das Spektrum verdeutlichen.
Die Röntgenkristallographie bietet eine hochauflösende Methode zur Bestimmung der dreidimensionalen Anordnung der Atome innerhalb eines Kristalls. Diese Technik ist besonders nützlich, um ATP zu analysieren und genaue Aussagen über die molekulare Geometrie zu treffen.
Zusätzlich wird die Infrarotspektroskopie genutzt, um Vibrationsmoden in Molekülen zu identifizieren. Dies hilft dabei, chemische Bindungen, wie kovalente Bindungen und Wasserstoffbrückenbindungen, zu charakterisieren.
Die Massenspektrometrie gibt präzise Auskunft über das Molekulargewicht und die Zusammensetzung eines Moleküls. Durch Ionisierung und Fragmentierung lassen sich detaillierte Strukturdaten ableiten.
Jede dieser Methoden trägt dazu bei, ein umfassendes Bild von Atome und Moleküle und deren Verbindungen zu erhalten. So wird in der modernen Chemie eine Vielzahl an Analyseverfahren eingesetzt, um spezifische Informationen über die chemischen Eigenschaften und Reaktivitäten darzustellen. integrationsfähig
| Begriff | Beschreibung | Beispiel |
|---|---|---|
| Elektronenpaarbindungen | Bindungen, bei denen zwei Atome ein gemeinsames Elektronenpaar teilen. | H2O (Wasser) |
| Polarität von Molekülen | Verteilung der elektrischen Ladung in einem Molekül, die zu Dipol-Dipol-Wechselwirkungen führen kann. | NH3 (Ammoniak) |
| Molekülorbitaltheorie | Theorie, die beschreibt, wie atomare Orbitale zu Molekülorbitalen kombiniert werden. | O2 (Sauerstoff) |
Anwendung von Molekülen in der Industrie
Moleküle finden in vielen Industriezweigen breite Anwendung. Besonders hervorzuheben sind ihre Rollen in der Pharmazeutischen Industrie. Hier werden spezifisch designte Moleküle zur Herstellung von Medikamenten und Impfstoffen verwendet. Durch das Verständnis der Molekülstruktur und der chemischen Bindungen können Wissenschaftler Wirkstoffe entwickeln, die bestimmte Krankheiten gezielt bekämpfen.
Auch die Kunststoffherstellung basiert auf der Synthese und Polymerisation von Molekülen. Polymere bestehen aus langen Ketten von wiederholten Molestrukturen, welche durch kovalente Bindungen miteinander verknüpft sind. Diese Materialien besitzen Eigenschaften wie Flexibilität und Haltbarkeit, die industriell von hoher Bedeutung sind.
In der Lebensmittelindustrie spielen Moleküle eine kritische Rolle bei der Entwicklung von Aromen und Konservierungsstoffen. Chemische Analysen und Simulationen mit Hilfe von Molekülmodellen ermöglichen es, neue Rezepte zu kreieren und Produkte länger haltbar zu machen.
Die Energiebranche profitiert ebenfalls von molekularer Forschung. Die Effizienz von Solarzellen und Batterien hängt stark von den verwendeten Materialien auf molekularer Ebene ab. Forscher arbeiten daran, bessere Molekülorbitale und Resonanzstrukturen zu identifizieren, um die Leistungsfähigkeit dieser Technologien zu optimieren.
Zusammengefasst zeigt sich, dass ein tiefes Verständnis von Atomen und Molekülen für zahlreiche industrielle Anwendungen unabdingbar ist. Durch interdisziplinäre Zusammenarbeit zwischen Chemikern, Ingenieuren und anderen Fachrichtungen wird weiterhin an neuen Innovationen gearbeitet, die unser tägliches Leben prägen.
Biologische Funktion und Bedeutung von Molekülen
Moleküle spielen eine entscheidende Rolle bei den biologischen Funktionen des Lebens. Sie sind die Bausteine aller lebenden Organismen, wobei jedes Molekül spezifische Aufgaben übernimmt.
Proteine, welche aus Aminosäuren bestehen, sorgen für Struktur und Funktionalität in Zellen. Beispiele hierfür sind Enzyme, die als Katalysatoren chemische Reaktionen innerhalb des Körpers erheblich beschleunigen. Kohlenhydrate dienen als kurzfristige Energiequellen und tragen zur Zellidentifikation sowie -kommunikation bei.
DNA und RNA, beides Nukleinsäuren, enthalten die genetische Information, die für die Reproduktion und Entwicklung von Lebewesen notwendig ist. Diese Makromoleküle ermöglichen es Organismen, ihre Erbinformationen an nachfolgende Generationen weiterzugeben, wodurch sie sicherstellen, dass lebenswichtige Eigenschaften erhalten bleiben.
Lipide, wie Fette und Öle, stellen ebenfalls bedeutende Biomoleküle dar. Sie fungieren nicht nur als langfristige Energiespeicher, sondern sind auch wichtige Bestandteile der Zellmembranen. Dort fördern sie die Flexibilität und Stabilität der Membranstruktur.
Darüber hinaus fungieren viele molekulare Verbindungen als Signalmoleküle, einschließlich Hormonen und Neurotransmittern. Diese steuern verschiedene physiologische Prozesse im Körper und gewährleisten die Kommunikation zwischen unterschiedlichen Zelltypen.
Durch das Verständnis der verschiedenen biologischen Rollen von Molekülen können Wissenschaftler neue pharmakologische Ansätze entwickeln und Krankheiten effektiver behandeln. Kurz gesagt, ohne die vielfältigen und komplexen Funktionen von Molekülen wäre das Leben, wie wir es kennen, nicht möglich.
Zukunftstrends in der Molekülforschung
Eines der bedeutendsten Zukunftsthemen in der Molekülforschung ist die Entwicklung neuer Methoden zur Analyse von Molekülen. Fortschritte in der molekularen Spektroskopie und in der Nutzung von Quantencomputern versprechen präzisere und detailliertere Einsichten in die Struktur und die Eigenschaften von Molekülen. Diese Technologien können dazu beitragen, komplexe chemische Reaktionen besser zu verstehen und neue Materialien mit maßgeschneiderten Eigenschaften zu entwickeln.
Ein weiterer wichtiger Trend ist die Nachhaltigkeit in der Chemie. Forschung wird zunehmend darauf konzentriert, umweltfreundliche und nachhaltige chemische Prozesse zu entwickeln. Dies schließt die Synthese von Molekülen ein, die weniger Abfallprodukte erzeugen oder aus nachwachsenden Rohstoffen hergestellt werden können. Hierbei spielen intermolekulare Kräfte und Wasserstoffbrückenbindungen eine wesentliche Rolle, da sie die Effizienz und Selektivität chemischer Prozesse beeinflussen.
Auch der Bereich der Medizin profitiert erheblich von Fortschritten in der Molekülstruktur-Forschung. Die Entwicklung neuer Medikamente wird durch das Verständnis der molekularen Geometrie und der Elektronenpaarbindungen beschleunigt. Insbesondere die Molekülorbitaltheorie hilft dabei, die Wechselwirkungen zwischen Wirkstoffen und biologischen Molekülen vorherzusagen und zu optimieren.
Zusammengefasst zeigen diese Trends, dass die Verbindung von innovativen Technologien und nachhaltigen Prinzipien zentrale Elemente künftiger Forschungen sein werden. Sie ermöglichen nicht nur tiefergehende wissenschaftliche Erkenntnisse, sondern tragen auch maßgeblich zu praktischen Anwendungen in verschiedenen Industriezweigen bei.