Chemische Reaktionen sind fundamentale chemische Prozesse, bei denen die Struktur und Zusammensetzung von Stoffen verändert werden. Diese Veränderungen können in verschiedene Reaktionstypen unterteilt werden, die jeweils spezifische Eigenschaften und Mechanismen aufweisen.
Von der Übertragung von Protonen bei Säure-Base-Reaktionen bis hin zu Elektronentransfer und Oxidationszustandsänderungen bei Redoxreaktionen gibt es vielfältige spannende chemische Reaktionen zu entdecken. Eine zentrale Rolle spielen dabei die Reaktanten und Produkte, die sich während eines Reaktionsverlaufs bilden und umwandeln.
Beim Verständnis dieser Reaktionen ist es wichtig, Reaktionsmechanismen sowie Faktoren wie Katalysatoren und die dafür erforderliche Aktivierungsenergie zu berücksichtigen. Exotherme und Endotherme Reaktionen sind Beispiele für unterschiedliche energetische Betrachtungen dieser spannenden chemischen Phänomene.
Das Wichtigste in Kürze
- Chemische Reaktionen verändern die Struktur und Zusammensetzung von Stoffen.
- Säure-Base-Reaktionen: Protonenübertragungen zwischen Molekülen.
- Redox-Reaktionen: Elektronentransfer und Oxidationszustandsänderungen.
- Substitutionsreaktionen: Austauschen von Atomen in Molekülen.
- Eliminierungsreaktionen: Abspaltung von Atomen aus Molekülen.
In der Chemie gibt es verschiedene Reaktionstypen, die auf den Austausch von Atomen oder Molekülen basieren. Drei der wichtigsten Reaktionstypen sind die Synthese (Bildung einer Verbindung), die Zersetzung (Aufspaltung einer Verbindung in einfachere Bestandteile) und die Substitutionsreaktion (Austausch von Atomen oder Gruppen in einer Verbindung). Diese Reaktionstypen sind grundlegend für das Verständnis chemischer Prozesse und spielen eine entscheidende Rolle in der organischen und anorganischen Chemie.
| Reaktionstyp | Beschreibung |
|---|---|
| Säure-Base-Reaktionen | Protonenübertragung zwischen Molekülen |
| Redox-Reaktionen | Elektronentransfer und Oxidationszustandsänderungen |
| Substitutionsreaktionen | Austauschen von Atomen in Molekülen |
| Additionsreaktionen | Anhängen von Atomen an Doppelbindungen |
| Eliminierungsreaktionen | Abspaltung von Atomen aus Molekülen |
| Kondensationsreaktionen | Bildung von größeren Molekülen unter Wasserabspaltung |
| Zersetzungsreaktionen | Zerfall von Molekülen in kleinere Einheiten |
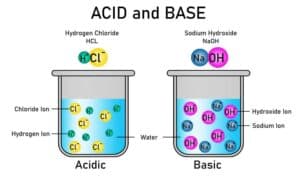
Säure-Base-Reaktionen: Protonenübertragungen zwischen Molekülen
Säure-Base-Reaktionen sind ein fundamentales Konzept in der Chemie. Sie beinhalten die Übertragung von Protonen (H⁺-Ionen) zwischen Molekülen. Bei solchen chemischen Reaktionen gibt es immer zwei Hauptkomponenten: Säuren und Basen. Eine Säure ist ein Stoff, der Protonen abgeben kann, während eine Base diese Protonen aufnehmen kann.
Ein klassisches Beispiel für eine Säure-Base-Reaktion ist die Reaktion von Salzsäure (HCl) mit Natriumhydroxid (NaOH). In diesem Fall gibt HCl ein Proton an NaOH ab, wodurch Wasser (H₂O) und das Salz Natriumchlorid (NaCl) entstehen. Dieses Prinzip lässt sich auf zahlreiche andere chemische Prozesse anwenden, bei denen Protonenübertragungen eine zentrale Rolle spielen.
Die Reaktionsmechanismen solcher Prozesse können sehr unterschiedlich sein und variieren je nach den beteiligten Substanzen. Dabei beeinflussen Katalysatoren häufig die Reaktionsgeschwindigkeit und senken die notwendige Aktivierungsenergie, um den Prozess effizienter zu gestalten.
Es gibt sowohl exotherme als auch endotherme Säure-Base-Reaktionen. Bei exothermen Reaktionen wird Energie freigesetzt, während sie bei endothermen Reaktionen aufgenommen wird. Die energetische Betrachtung dieser Reaktionen ist entscheidend für das Verständnis von chemischen Prozessen im Detail.
Zusätzlich spielt das Prinzip des Gleichgewichtszustands bei vielen Säure-Base-Reaktionen eine wichtige Rolle. Im dynamischen Gleichgewicht reagieren die Reaktanten (Säuren und Basen) und Produkte gleichzeitig miteinander, ohne dass sich ihre Konzentrationen merklich ändern. Dies ermöglicht stabile Reaktionsbedingungen über längere Zeiträume hinweg.
Verständnis dieser grundlegenden Prinzipien hilft erheblich beim Studium komplexer chemischer Systeme.
Die Chemie ist eine zauberhafte Wissenschaft; Sie versteht es, die Elemente zu neuen Stoffen zu formen. – Justus von Liebig
Redox-Reaktionen: Elektronentransfer und Oxidationszustandsänderungen
In der Chemie sind Redox-Reaktionen ein grundlegender Typ chemischer Reaktionen. Dabei handelt es sich um Prozesse, bei denen Elektronen zwischen verschiedenen Elementen oder Verbindungen übertragen werden. Diese Veränderungen treten häufig gemeinsam auf und betreffen die Oxidationszustände der beteiligten Atome.
Oxidation bezeichnet den Verlust von Elektronen, während Reduktion den Gewinn von Elektronen beschreibt. Beide Prozesse finden immer gleichzeitig statt, da die abgegebenen Elektronen eines Atoms von einem anderen Atom aufgenommen werden müssen. Die Substanzen, die Elektronen abgeben, nennt man Reduktionsmittel, und diejenigen, die Elektronen aufnehmen, werden als Oxidationsmittel bezeichnet.
Ein klassisches Beispiel für eine Redox-Reaktion ist die Verbrennung, etwa von Wasserstoff: H2 + O2 → H2O. Hierbei wird Wasserstoff oxidiert und Sauerstoff reduziert. Redoxreaktionen spielen auch eine zentrale Rolle in zahlreichen biologischen Prozessen und industriellen Verfahren, wie etwa in Batterien, Metallraffination und der Atmung.
Die Aktivierungsenergie, also die Energie, die nötig ist, um eine Reaktion zu starten, kann durch Katalysatoren gesenkt werden. Dies beschleunigt die Reaktionsgeschwindigkeit ohne die Reaktionsenthalpie, das heißt die gesamte Energiefreisetzung oder -aufnahme, zu beeinflussen.
Obwohl manche Redox-Reaktionen exotherm sind – also Wärme freisetzen – können andere endotherm sein und Wärme aufnehmen. Das Ergebnis dieser Prozesse ist oft ein dynamisches Gleichgewicht, bei dem die Hin- und Rückreaktionen im Gleichgewichtszustand gleich schnell ablaufen. Redox-Reaktionen sind daher ein faszinierendes Gebiet mit vielen praktischen Anwendungen und theoretischen Herausforderungen.
Beispiele Redox-Reaktionen:
- Die Reaktion von Eisen (Fe) mit Sauerstoff (O2) zur Bildung von Eisen(III)-oxid (Fe2O3) unter Freisetzung von Wärmeenergie
- Die Redox-Reaktion zwischen Kupfer (Cu) und Silbernitrat (AgNO3) zur Bildung von Silber (Ag) und Kupfer(II)-nitrat (Cu(NO3)2)
- Die Elektrolyse von Wasser (H2O) zur Bildung von Wasserstoffgas (H2) und Sauerstoffgas (O2) an den Elektroden
- Die Reduktion von Kupfer(II)-oxid (CuO) durch Wasserstoff (H2) zu Kupfer (Cu) und Wasser (H2O)
- Die Oxidation von Aluminium (Al) mit Salzsäure (HCl) zur Bildung von Aluminiumchlorid (AlCl3) und Wasserstoffgas (H2)
- Die Redox-Reaktion zwischen Kaliumpermanganat (KMnO4) und Oxalsäure zu Mangan(II)-ionen (Mn^2+) und Kohlendioxid (CO2)
Substitutionsreaktionen: Austauschen von Atomen in Molekülen
Substitutionsreaktionen sind eine Art von chemischen Reaktionen, bei denen Atome oder Atomgruppen innerhalb eines Moleküls durch andere Atome oder Gruppen ersetzt werden. Diese Reaktion spielt eine zentrale Rolle in der organischen Chemie und ist entscheidend für die Synthese vieler bedeutender Verbindungen.
Die grundlegende Dynamik besteht darin, dass ein Reaktant mit dem Zielmolekül reagiert und ein Teil des Moleküls durch den neuen Reaktanten substituiert wird. Dies kann durch verschiedene Mechanismen geschehen, darunter nukleophile und elektrophile Substitutionen. In einer nukleophilen Substitution fungiert das eintretende Nukleophil als Elektronenpaardonator und greift an einem positiv polarisierten Kohlenstoffatom an. Ein bekanntes Beispiel ist die Reaktion von Halogenalkanen mit Hydroxidionen.
Ein wichtiger Aspekt dieser Reaktionen ist, dass sie häufig unter bestimmten Bedingungen ablaufen müssen, wie die Anwesenheit von Katalysatoren oder bestimmte Lösungsmittel. Die Reaktionsgeschwindigkeit kann zudem stark variieren und hängt von verschiedenen Faktoren ab, einschließlich der Natur der Reaktanten und Produkte sowie der Temperatur.
Ein besonderes Augenmerk liegt auch auf der energetischen Betrachtung der Substitutionsreaktion. Während einige dieser Reaktionen exotherm sein können und Energie in Form von Wärme freisetzen, gibt es auch endotherme Reaktionen, die Energie benötigen. Die Aktivierungsenergie spielt dabei eine entscheidende Rolle für den Verlauf der Reaktion.
Durch die Fähigkeit, gezielt Atome zu ersetzen, ermöglichen Substitutionsreaktionen die maßgeschneiderte Herstellung komplexer Moleküle, was insbesondere für die pharmazeutische Industrie und die Materialwissenschaften von Bedeutung ist.
Beispiele Substitutionsreaktionen
- Die Substitution von Methan (CH4) mit Chlor (Cl2) unter UV-Licht zu Chloromethan (CH3Cl) und Chlorwasserstoff (HCl)
- Die Substitution von Ethan (C2H6) mit Chlor (Cl2) zu Dichlorethan (C2H4Cl2) und Chlorwasserstoff (HCl)
- Die elektrophile aromatische Substitution von Benzol (C6H6) mit Nitrierung zu Nitrobenzol (C6H5NO2)
- Die nucleophile Substitution von Chloroethan (C2H5Cl) mit Hydroxidionen zu Ethanol (C2H5OH)
- Die Substitution von Brommethan (CH3Br) durch Hydroxidionen zu Methanol (CH3OH)
- Die Substitution von Tetrachlormethan (CCl4) mit Wasserstoff zu Dichlormethan (CH2Cl2) und Chlorwasserstoff (HCl)
- Die nucleophile Substitution von Ethylchlorid (C2H5Cl) mit Ammoniak zu Ethylamin (C2H5NH2)
- Die Substitution von Toluol (C7H8) mit Chlor unter UV-Licht zu Chlorotoluol
- Die elektrophile aromatische Substitution von Naphtalin mit Brom zu Bromnaphthalin
Additionsreaktionen: Anhängen von Atomen an Doppelbindungen
Additionsreaktionen sind chemische Reaktionen, bei denen Atome oder Atomgruppen an eine vorhandene Doppelbindung eines Moleküls angefügt werden. Diese Art der chemischen Prozesse ist besonders wichtig in der Herstellung vieler organischer und industrieller Verbindungen.
Ein typisches Beispiel einer Additionsreaktion ist die Hydrierung, bei der Wasserstoffatome an eine Doppelbindung angehängt werden. Dies geschieht meistens unter Beteiligung von Katalysatoren, um die Aktivierungsenergie zu überwinden und die Reaktionsgeschwindigkeit zu erhöhen. Solche Reaktionen spielen eine bedeutende Rolle in der synthetischen Chemie wie auch in der Nahrungsmittelindustrie, beispielsweise bei der Umwandlung von Pflanzenölen in feste Fette.
Bei Additionsreaktionen handelt es sich oft um exotherme Prozesse, bei denen Energie freigesetzt wird. Das bedeutet, dass die entstehenden Produkte energetisch günstiger sind als die Reaktanten. Die entstehende Energie kann durch die Reaktionsenthalpie beschrieben werden. Andererseits gibt es auch endotherme Additionsreaktionen, die Energie benötigen, um abzulaufen.
In Bezug auf den Mechanismus können Additionsreaktionen über radikalische oder ionische Zwischenstufen verlaufen. Dieser Unterschied im Reaktionsmechanismus beeinflusst sowohl die Geschwindigkeit als auch das Ausmaß der Reaktion. Ein klassisches Szenario wäre die elektrophile Addition, bei der ein Elektrophil die Doppelbindung angreift und diese in eine Einfachbindung umformt.
Beispiele Additionsreaktionen
- Die Addition von Wasserstoff (H2) zu Ethin (C2H2) zu bilden Ethen (C2H4)
- Die Addition von Brom (Br2) zu Ethen (C2H4) zu bilden 1,2-Dibromethan (C2H4Br2)
- Die Hydrierung von Ethin (C2H2) mit Wasserstoff (H2) zu Ethen (C2H4)
- Die Addition von Bromwasser zu Propen (C3H6) zu bilden 1,2-Dibrompropan (C3H6Br2)
- Die Addition von Wasserstoff (H2) zu Propen (C3H6) in Gegenwart eines Katalysators zu Propan (C3H8)
- Die Hydrierung von Buten (C4H8) mit Wasserstoff (H2) in Gegenwart eines Katalysators zu Butan (C4H10)
- Die Addition von Halogenen wie Chlor oder Brom zu Alkenen wie Ethen oder Propen
- Die Addition von Wasserstoff an Alkine wie Ethin zur Bildung von Alkanen
- Die Hydrohalogenierung von Alkenen mit Halogenwasserstoffen wie HCl oder HBr
Abschließend sei erwähnt, dass das Verständnis dieser Reaktionen wesentlich für die Entwicklung neuer Materialien und die Optimierung bestehender Synthesewege ist. Von hohem Interesse sind dabei insbesondere Reaktionen, die unter milden Bedingungen und mit hoher Ausbeute ablaufen, um die Effizienz in der chemischen Produktion zu steigern.
Video: Reaktionstypen der Organischen Chemie
Eliminierungsreaktionen: Abspaltung von Atomen aus Molekülen
Eliminierungsreaktionen sind chemische Prozesse, bei denen Atome oder Atomgruppen aus einem Molekül entfernt werden. Diese Reaktionen führen oft zur Bildung einer Doppelbindung in den Produktmolekülen. Ein typisch bekanntes Beispiel ist die Dehydrohalogenierung, bei der ein Halogenatom und ein Wasserstoffatom von benachbarten Kohlenstoffatomen eines Alkans eliminiert werden, um ein Alken zu bilden.
Reaktionsmechanismen bei Eliminierungen können entweder direkt sein, wie beim E2-Mechanismus (bimolekulare Eliminierung), oder schrittweise ablaufen, wie beim E1-Mechanismus (unimolekulare Eliminierung). Im E2-Mechanismus treten beide Reaktanten gleichzeitig auf, wobei die Abspaltung von Atomen synchron stattfindet. Dieser Prozess erfordert oftmals eine hohe Aktivierungsenergie, da Übergangszustände mit hoher Energie entstehen.
Bei der E1-Reaktion hingegen läuft die Eliminierung über Zwischenschritte ab, häufig unter Beteiligung von Katalysatoren. Hier entsteht zuerst ein Carbokation als Zwischenprodukt, bevor die eigentliche Eliminierung stattfindet.
Die energetische Betrachtung dieser Reaktionen zeigt, dass Eliminationen meist endotherme Reaktionen sind, was bedeutet, dass sie Energie benötigen. Ihre Geschwindigkeit kann durch Faktoren wie Temperatur, Lösungsmittel oder die Art der beteiligten Basen beeinflusst werden.
Es gibt auch dynamische Gleichgewichte bei Eliminierungen. Das heißt, es existiert ein Gleichgewichtszustand zwischen den Edukten und Produkten der Reaktion. Die Kontrolle über solche Reaktionen spielt eine wesentliche Rolle in der organischen Synthese, besonders bei der Herstellung komplexer Moleküle wie Polymere.
Beispiele Eliminierungsreaktionen
- Die Eliminierung von Wasser aus Ethanol (C2H5OH) zur Bildung von Ethen (C2H4)
- Die Dehydratisierung von Alkoholen wie Butanol zu Alkenen wie Buten unter Einwirkung von Säuren
- Die Eliminierung von Wasserstoff aus Cyclohexanol zur Bildung von Cyclohexen durch thermische Dehydratisierung
- Die Eliminierungsreaktion von Bromethan (CH3CH2Br) zu Ethen (C2H4) und Wasserstoffbromid (HBr)
- Die Eliminierung von Ammoniak aus Ethylammoniumchlorid zur Bildung von Ethen durch Deaminierung
- Die Dehydratisierung von Ethylenglycol zu Ethen unter Erhitzung in Gegenwart eines Katalysators
Kondensationsreaktionen: Bildung von größeren Molekülen unter Wasserabspaltung
Kondensationsreaktionen sind chemische Prozesse, bei denen zwei oder mehrere Moleküle zu einem größeren Molekül reagieren, während gleichzeitig ein kleines Molekül wie Wasser abgespalten wird. Diese Reaktion ist typisch für die Bildung von Polymeren aus Monomeren und spielt daher eine wichtige Rolle in der Polymerisation.
Ein klassisches Beispiel für eine Kondensationsreaktion ist die Synthese von Polyestern. Bei dieser Reaktion reagieren Diols (zweiwertige Alkohole) mit Dicarbonsäuren unter Abspaltung von Wasser zu Polyesterketten. Dabei entstehen lange Kettenmoleküle, die in vielen Materialien des täglichen Lebens verwendet werden, wie zum Beispiel in Textilfasern und Kunststoffen.
Ein anderer Bereich, in dem Kondensationsreaktionen vorkommen, sind biologische Systeme. Hier treten sie oft bei der Bildung von Proteinen durch Peptidbindungen zwischen Aminosäuren auf. Auch hier wird beim Verbinden der Aminosäuren Wasser freigesetzt, was entscheidend für den Aufbau der komplexen Proteinstrukturen ist.
Die Reaktionsmechanismen solcher Kondensationsprozesse können variieren, aber das Grundprinzip bleibt gleich: Zwei kleinere Moleküle verbinden sich unter Verlust eines kleinen Moleküls. Oftmals benötigen diese Reaktionen einen Katalysator zur Senkung der Aktivierungsenergie und zur Beschleunigung der Reaktionsgeschwindigkeit.
Insgesamt spielen Kondensationsreaktionen eine entscheidende Rolle in der organischen Synthese und Biochemie aufgrund ihrer Fähigkeit, komplexe, größere Strukturen aus einfacheren Einheiten herzustellen. Die Reaktionsenthalpie dieser Vorgänge kann je nach spezifischer Reaktion stark variieren, weswegen sowohl exotherme als auch endotherme Beispiele existieren.
Beispiele für Kondensationsreaktionen
- Die Bildung von Polyester aus Dicarbonsäuren und Diolen unter Abspaltung von Wasser
- Die Kondensation von Aminosäuren zu Proteinen unter Abspaltung von Wasser
- Die Bildung von Polysacchariden wie Stärke oder Cellulose aus Monosacchariden durch Kondensationsreaktionen
- Die Herstellung von Polyamiden wie Nylon durch die Reaktion von Dicarbonsäuren mit Diaminen unter Abspaltung von Wasser
- Die Kondensation von Glycerin mit Fettsäuren zur Bildung von Triglyceriden (Fette) mit Freisetzung von Wasser
Zersetzungsreaktionen: Zerfall von Molekülen in kleinere Einheiten
Zersetzungsreaktionen sind chemische Prozesse, bei denen ein Molekül in kleinere Einheiten zerlegt wird. Diese Art von Reaktion spielt eine entscheidende Rolle in verschiedenen Bereichen der Chemie, sowohl in industriellen Anwendungen als auch im täglichen Leben.
Ein bekanntes Beispiel ist die Elektrolyse von Wasser zu Sauerstoff und Wasserstoff. Hierbei wird elektrische Energie genutzt, um das Wassermolekül zu spalten. Es entstehen zwei Gase, die vielfältig verwendet werden können.
Reaktanten und Produkte in Zersetzungsreaktionen variieren je nach spezifischer Reaktion. Oft benötigt man eine Aktivierungsenergie, um den Zerfall einzuleiten, da Moleküle stabil sind und nicht spontan zerfallen. Ein Katalysator kann diesen Prozess beschleunigen, indem er die Aktivierungsenergie senkt.
Solche Reaktionen können sowohl endotherm als auch exotherm sein. Bei endothermen Reaktionen wird Energie aufgenommen, während bei exothermen Reaktionen Energie freigesetzt wird. Die energetische Betrachtung einer Reaktion hilft dabei, die Reaktionsenthalpie zu bestimmen.
Die Reaktionsgeschwindigkeit dieser Vorgänge kann durch verschiedene Faktoren beeinflusst werden. Beispielsweise spielen Temperatur, Konzentration der Reaktanten und die Anwesenheit eines Katalysators eine Rolle. Zersetzungsreaktionen tragen häufig auch zur Erreichung eines Gleichgewichtszustands bei, besonders wenn sie Teil eines dynamischen Gleichgewichts sind.
Einer der bemerkenswerten Aspekte der Zersetzung ist ihr Vorkommen in biologischen Systemen. In der Natur werden organische Stoffe durch Mikroorganismen zersetzt, was essentiell für die Kreisläufe von Nährstoffen ist.
Beispiele für Zersetzungsreaktionen
- Die Zersetzung von Wasserstoffperoxid (H2O2) in Wasser (H2O) und Sauerstoffgas (O2)
- Die thermische Zersetzung von Calciumcarbonat (CaCO3) zu Calciumoxid (CaO) und Kohlendioxid (CO2)
- Die Zersetzung von Ammoniumnitrat (NH4NO3) zu Stickstoffgas (N2), Wasser (H2O) und Sauerstoffgas (O2)
- Die Zersetzung von Wasser (H2O) in Wasserstoffgas (H2) und Sauerstoffgas (O2) durch Elektrolyse
- Die thermische Zersetzung von Natriumchlorat (NaClO3) zu Natriumchlorid (NaCl) und Sauerstoffgas (O2)
- Die Zersetzung von Wasserstoffbromid (HBr) zu Wasserstoffgas (H2) und Bromgas (Br2)
- Die thermische Zersetzung von Kaliumpermanganat (KMnO4) zu Kaliummanganat (K2MnO4), Mangan(IV)-oxid (MnO2) und Sauerstoffgas (O2)
- Die Zersetzung von Bariumchlorat (Ba(ClO3)2) zu Bariumchlorid (BaCl2) und Sauerstoffgas (O2)
Abschließend lässt sich festhalten, dass Zersetzungsreaktionen sowohl in natürlichen Prozessen als auch in technischen Anwendungen eine wichtige Funktion erfüllen.
Fazit
| Reaktionstyp | Mechanismus | Beispiel |
|---|---|---|
| Säure-Base-Reaktionen | Protonenübertragung | HCl + NaOH → NaCl + H₂O |
| Redox-Reaktionen | Elektronentransfer | H₂ + O₂ → H₂O |
| Substitutionsreaktionen | Austauschen von Atomen | CH₃Cl + OH⁻ → CH₃OH + Cl⁻ |
| Additionsreaktionen | Anfügen von Atomen | C₂H₄ + H₂ → C₂H₆ |
| Eliminierungsreaktionen | Abspaltung von Atomen | C₂H₆ → C₂H₄ + H₂ |
| Kondensationsreaktionen | Bildung größerer Moleküle | HOCH₂-CH₂OH → HOCH₂-CH₂O-CH₂-CH₂OH + H₂O |
| Zersetzungsreaktionen | Zerfall von Molekülen | CaCO₃ → CaO + CO₂ |