Was sind Reinstoffe und Stoffgemische?
Der Unterschied zwischen einem Reinstoff und einem Stoffgemisch erklärt sich aus ihrer chemischen Zusammensetzung. Ein Reinstoff hat eine einheitliche, feste chemische Zusammensetzung und besteht aus nur einer Art von Teilchen. Beispiele dafür sind Wasser, Sauerstoff und Gold. Im Gegensatz dazu ist ein Stoffgemisch eine Kombination mehrerer Stoffe mit unterschiedlichen Eigenschaften.
Zu den homogenen Gemischen gehören Legierungen und Salzwasser, während heterogene Gemische wie z.B. die Mischung von Sand und Eisenspänen variabler in ihrer Zusammensetzung sind. Die Trennbarkeit ist ein weiteres Unterscheidungsmerkmal: Stoffgemische können physikalisch getrennt werden, wohingegen Reinstoffe meist nur chemisch in ihre Elemente zerlegbar sind.
Einheitsstoffe wie reines Eisen oder Kupfer zeigen konsistente physikalische Eigenschaften sowie eine hohe chemische Reinheit. Bei Stoffgemischen hängt die Leistung oft vom Mischungsverhältnis ab, was sich direkt auf ihre physikalischen Eigenschaften auswirkt. Typische Trennmethoden für Gemische umfassen Destillation, Filtration und Extraktion.
Das Wichtigste in Kürze
- Reinstoff: Ein Stoff mit einheitlicher, fester chemischer Zusammensetzung, z.B. Wasser (H₂O) oder Gold (Au).
- Stoffgemisch: Kombination mehrerer Stoffe mit variabler Zusammensetzung, z.B. Luft oder Salzwasser.
- Trennmethoden: Stoffgemische können physikalisch getrennt werden, z.B. durch Destillation oder Filtration.
- Konsistenz: Reinstoffe zeigen konstante physikalische Eigenschaften und chemische Stabilität.
- Variabilität: Stoffgemische zeigen Eigenschaften, die vom Mischungsverhältnis der Komponenten abhängen.
Ein Reinstoff besteht aus nur einer Art von chemischem Element oder Verbindung, während ein Stoffgemisch aus zwei oder mehr verschiedenen Arten von Substanzen besteht. Reinstoffe können nicht weiter in andere Substanzen durch physikalische Methoden unterteilt werden, während Stoffgemische durch physikalische Verfahren wie Filtration oder Destillation getrennt werden können.
Definition Reinstoff: Einheitlich, feste chemische Zusammensetzung
Ein Reinstoff zeichnet sich durch eine einheitliche und feste chemische Zusammensetzung aus. Dies bedeutet, dass der Stoff nur aus einer einzigen Sorte von Molekülen oder Atomen besteht. Diese spezifische Eigenschaft unterscheidet Reinstoffe von den vielfältigen Gemischen, die im Alltag häufig auftreten.
Reinstoffe sind in ihrer Struktur und ihrem Verhalten konsistent. Beispielsweise hat reines Wasser immer dieselbe chemische Formel (H₂O) und physikalische Eigenschaften wie Siedepunkt, Schmelzpunkt und Dichte. Auch andere Einheitsstoffe wie Sauerstoff (O₂) oder Gold (Au) zeigen diese Konsistenz.
Die strikte Homogenität von Reinstoffen macht sie unverzichtbar für zahlreiche wissenschaftliche und industrielle Anwendungen. Durch ihre definierten physikalischen Eigenschaften können sie unter kontrollierten Bedingungen verwendet werden, ohne dass das Ergebnis durch Verunreinigungen beeinflusst wird.
Der Begriff chemische Reinheit spielt daher eine entscheidende Rolle bei der Klassifizierung von Stoffen. Um einen Reinstoff von einem Gemisch zu unterscheiden, kommen verschiedene Analyseverfahren zum Einsatz, die die molekulare und atomare Zusammensetzung bewerten.
Insgesamt bietet ein Reinstoff aufgrund seiner festen chemischen Zusammensetzung eine verlässliche Basis für Forschung, Entwicklung und Produktion. Sein gleichbleibendes Verhalten ermöglicht präzise Voraussagen, die bei variablen Stoffgemischen nicht immer möglich sind.
Die Genauigkeit der chemischen Experimente hängt entscheidend von der Reinheit der eingesetzten Stoffe ab. – Justus von Liebig
| Reinstoffe | Stoffgemische |
|---|---|
| Wasser (H₂O) | Luft |
| Sauerstoff (O₂) | Legierungen |
| Gold (Au) | Salzwasser |
| Reines Eisen (Fe) | Sand und Eisenspäne |
Definition Stoffgemisch: Kombination mehrerer Stoffe verschiedener Eigenschaften
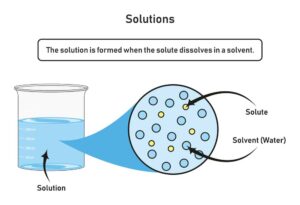
Ein Stoffgemisch ist eine Kombination mehrerer Stoffe, die verschiedene physikalische Eigenschaften aufweisen. Im Gegensatz zu Reinstoffen haben Stoffgemische keine einheitliche chemische Zusammensetzung. Die einzelnen Bestandteile eines Gemisches behalten ihre eigenen chemischen und physikalischen Eigenschaften bei.
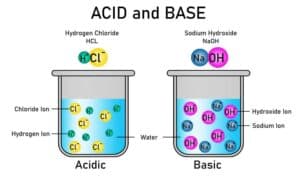
Es gibt zwei Haupttypen von Stoffgemischen: homogene und heterogene. Homogene Gemische sind gleichmäßig verteilt und erscheinen als einheitliche Phase. Ein klassisches Beispiel hierfür wäre eine Salzlösung in Wasser. Alle molekularen Komponenten sind vollständig gelöst und durchmässig verteilt.
Heterogene Gemische bestehen aus mehreren Phasen, deren Bestandteile erkennbar separat bleiben. Granit besteht beispielsweise aus verschiedenen Mineralien, die mit bloßem Auge unterscheidbar sind.
Die Trennbarkeit von Stoffgemischen spielt eine entscheidende Rolle in der Chemie und Industrie. Verschiedene Methoden wie Destillation, Filtration oder Chromatographie können verwendet werden, um die einzelnen Bestandteile aufgrund ihrer unterschiedlichen physikalischen und chemischen Eigenschaften zu separieren.
Stoffgemische können in festen, flüssigen oder gasförmigen Zuständen vorkommen. Ein bekanntes Beispiel für ein gasförmiges Gemisch ist Luft, das mehrere Gas-Komponenten wie Sauerstoff, Stickstoff und Kohlendioxid enthält. In industriellen Prozessen werden komplexe Trennanlagen eingesetzt, um die gewünschten Einzelkomponenten aus einem Gemisch zu isolieren.
Beispiele Reinstoffe: Wasser, Sauerstoff, Gold
- Gold (Au)
- Sauerstoff (O2)
- Wasserstoff (H2)
- Diamant (C)
- Quecksilber (Hg)
- Stickstoff (N2)
- Jod (I2)
- Kohlenstoffdioxid (CO2)
- Silber (Ag)
- Aluminium (Al)
- Schwefel (S)
- Chlor (Cl2)
Reinstoffe sind Materialien, die aus nur einer Art von Teilchen bestehen und somit eine einheitliche chemische Zusammensetzung aufweisen. Zu den bekanntesten Reinstoffen gehören Wasser (H2O), Sauerstoff (O2) und Gold (Au). Diese Beispiele verdeutlichen die Bandbreite der Reinstoffe, da sie sich in ihren Aggregatzuständen und physikalischen Eigenschaften stark unterscheiden.
Wasser ist bei Raumtemperatur und Normaldruck eine Flüssigkeit mit einzigartigen Eigenschaften, wie z.B. seiner hohen Wärmekapazität und Anomalie des Wassers, die für das Leben unerlässlich sind. Es stellt einen Einheitsstoff dar, dessen Molekülstruktur aus zwei Wasserstoffatomen und einem Sauerstoffatom besteht.
Sauerstoff, ein weiteres Beispiel, liegt als Gas vor und ist essenziell für die Atmung aller aeroben Organismen. Seine chemische Reinheit kann in Labors leicht nachgewiesen werden, und es spielt eine zentrale Rolle bei vielen chemischen Reaktionen, insbesondere bei der Verbrennung.
Gold hingegen ist ein festes Metall mit hohem Glanz und herausragender chemischer Stabilität. Es besitzt einzigartige elektrische Leitfähigkeiten und wird oft wegen seiner Beständigkeit gegen Korrosion geschätzt. Aufgrund dieser Eigenschaften ist es seit Jahrtausenden eines der begehrtesten Edelmetalle.
Diese Reinstoffbeispiele illustrieren die Vielfalt und Bedeutung unterschiedlicher Stoffarten, welche durch ihre chemische Zusammensetzung klar definiert werden können.
Beispiele Stoffgemische: Luft, Legierungen, Salzwasser
- Luft (Gemisch aus Stickstoff, Sauerstoff, Kohlendioxid, etc.)
- Salzwasser (Wasser mit gelöstem Natriumchlorid)
- Benzin (Gemisch aus verschiedenen Kohlenwasserstoffen)
- Milch (Gemisch aus Wasser, Fett, Proteinen, etc.)
- Bronze (Legierung aus Kupfer und Zinn)
- Stahl (Legierung aus Eisen und Kohlenstoff)
- Luftschadstoffe (Gemisch aus verschiedenen Schadstoffen in der Luft)
- Seewasser (Wasser mit gelösten Salzen und Mineralien)
- Beton (Gemisch aus Zement, Sand, Kies und Wasser)
- Kaffee (Gemisch aus Wasser, Koffein, Aromastoffen usw.)
- Kunststoff (Gemisch aus Polymeren und verschiedenen Additiven)
- Boden (Gemisch aus Mineralien, organischen Stoffen, Wasser und Luft)
- Rauch (Gemisch aus festen und gasförmigen Teilchen)
- Essig (Gemisch aus Wasser und Essigsäure)
- Ammoniaklösung (Gemisch aus Wasser und Ammoniak)
- Messing (Legierung aus Kupfer und Zink)
- Glasschmelze (Gemisch aus Sand, Kalk und Soda)
- Kunstharz (Gemisch aus Kunststoffpolymeren und Additiven)
Es gibt viele verschiedene Beispiele für Stoffgemische, die im Alltag vorkommen. Ein sehr bekanntes Beispiel ist Luft. Luft ist ein homogenes Gemisch aus verschiedenen Gasen wie Stickstoff, Sauerstoff und kleinen Mengen anderer Gase. Die genaue chemische Zusammensetzung der Luft kann variieren, aber sie bleibt stets ein Stoffgemisch.
Ein weiteres Beispiel sind Legierungen. Legierungen sind feste homogene Mischungen von Metallen oder von Metallen mit anderen Elementen. Durch das Verschmelzen verschiedener Metalle entsteht eine neue Substanz mit verbesserten physikalischen Eigenschaften wie erhöhter Festigkeit oder Korrosionsbeständigkeit. Bronze, bestehend aus Kupfer und Zinn, und Stahl, welcher hauptsächlich aus Eisen und Kohlenstoff besteht, sind klassische Beispiele für Legierungen.
Salzwasser ist ebenfalls ein weit verbreitetes Stoffgemisch. Es handelt sich dabei um eine Lösung, bei der Salz (Natriumchlorid) in Wasser gelöst wird. Salzwasser zeigt typische Eigenschaften eines homogenen Gemisches, wobei die Konzentration des Salzes sowohl den Geschmack als auch die physikalischen Eigenschaften beeinflusst.
Alle diese Stoffgemische können durch physikalische Trennverfahren analysiert und aufgetrennt werden. Dies umfasst Methoden wie Destillation, Filtration oder Kristallisation, abhängig von der Art des Stoffgemisches und der gewünschten Reinheit des Endprodukts.
Während Reinstoffe oft spezielle Anwendungen erfordern, bieten Stoffgemische durch ihre Mischung unterschiedlicher Komponenten Flexibilität und breit gefächerte Nutzungsmöglichkeiten.
Trennbarkeit: Stoffgemische können physikalisch getrennt werden
Stoffgemische bestehen aus mehreren verschiedenen Komponenten und können mit Hilfe von physikalischen Trennverfahren wieder in ihre einzelnen Bestandteile zerlegt werden. Diese Methoden nutzen die unterschiedlichen physikalischen Eigenschaften der Mischungskomponenten, wie zum Beispiel Dichte, Siedepunkt oder Löslichkeit.
Ein häufiges Verfahren ist die Filtration, bei der feste Partikel durch ein Filtermedium von einer Flüssigkeit getrennt werden. Ein weiteres Beispiel ist die Destillation, bei der sich die unterschiedlichen Siedepunkte der Substanzen zunutze gemacht werden, um sie voneinander zu trennen.
Auch chromatographische Verfahren sind weit verbreitet. Dabei werden Stoffe aufgrund ihrer unterschiedlichen Wechselwirkungen mit einem Trägermaterial separiert. Andere Techniken umfassen die Zentrifugation, bei der Partikel durch schnelle Rotation basierend auf ihrer Dichte getrennt werden.
Ein besonderes Merkmal von Stoffgemischen ist, dass sie sowohl als homogene Gemische (gleichmäßig verteilte Komponenten) als auch als heterogene Gemische (ungleichmäßig verteilte Komponenten) vorliegen können. Homogene Gemische, wie etwa Salzwasser, erscheinen einheitlich, während heterogene Gemische, wie Sand in Wasser, unterschiedliche Phasen aufweisen.
Das Verständnis dieser Prinzipien ist wesentlich für viele industrielle Anwendungen, bei denen es gilt, spezifische Komponenten zu isolieren oder zu reinigen. Dies erfordert oft den Einsatz spezialisierter Trennanlagen, die das entsprechende Analyseverfahren unterstützen.
| Stoffart | Beispiel | Aggregratzustand |
|---|---|---|
| Reinstoff | Wasser (H₂O) | Flüssig |
| Reinstoff | Sauerstoff (O₂) | Gasförmig |
| Reinstoff | Gold (Au) | Fest |
| Stoffgemisch | Luft | Gasförmig |
| Stoffgemisch | Salzwasser | Flüssig |
| Stoffgemisch | Granit | Fest |
Reinstoffe: Nur chemisch in Elemente zerlegbar
Ein Reinstoff zeichnet sich dadurch aus, dass er eine einheitliche und klar definierte chemische Zusammensetzung besitzt. Dies bedeutet, dass alle Teilchen eines Reinstoffs identisch sind und die gleichen physikalischen Eigenschaften aufweisen. Ein wesentliches Merkmal von Reinstoffen ist ihre chemische Stabilität. Sie können nur durch chemische Verfahren in ihre elementaren Bestandteile zerlegt werden.
Wenn man sich zum Beispiel Wasser (H₂O) ansieht, besteht es immer aus zwei Wasserstoffatomen und einem Sauerstoffatom, unabhängig davon, woher das Wasser stammt. Diese Molekülstruktur bleibt konstant und verändert sich nicht spontan.
Im Gegensatz zu Stoffgemischen können Reinstoffe nicht einfach getrennt oder in andere Bestandteile zerlegt werden. Hierbei kommen Technik und Chemie ins Spiel: Durch spezifische Analyseverfahren und Trennmethoden, wie Elektrolyse bei Wasser, kann der Reinstoff in seine Komponenten aufgespalten werden. Dies erfordert jedoch den Einsatz besonderer Verfahren und oft erhebliche Energie.
Diese Fähigkeit zur Auftrennung zeigt, dass Reinstoffe höhere Anforderungen an die Trennungstechnologie stellen, als dies bei Stoffgemischen der Fall ist. Zudem bietet die Kenntnis über die chemische Zusammensetzung eines Reinstoffs entscheidende Vorteile für bestimmte Anwendungen in der Industrie und Forschung, da sie verlässliche |Leistung| und vorhersehbare Ergebnisse garantieren können.
Zusammengefasst lassen sich Reinstoffe aufgrund ihrer bestehen bleibenden Eigenschaften und der Notwendigkeit spezifischer chemischer Trennverfahren deutlich von gemischten Stoffen abgrenzen.
Eigenschaften Reinstoffe: Konsistent, definierte physikalische Werte
- Bestehen aus nur einer Art von chemischem Element oder Verbindung
- Können nicht weiter unterteilt werden
- Haben konstante physikalische und chemische Eigenschaften
- Besitzen einen eindeutigen Schmelz- und Siedepunkt
- Reagieren in chemischen Reaktionen immer gleich, unabhängig von der Menge
Ein zentraler Aspekt von Reinstoffen ist ihre Konstanz in Bezug auf ihre Eigenschaften und Zusammensetzung. Diese Stoffe zeichnen sich durch eine festgelegte chemische Zusammensetzung und spezifische physikalische Werte aus.
Reinstoffe wie Wasser (H₂O), Sauerstoff (O₂) oder Gold (Au) besitzen definierte und unveränderliche physikalische Eigenschaften wie Siedepunkt, Schmelzpunkt und Dichte. Beispielsweise hat Wasser bei Normaldruck immer einen Gefrierpunkt von 0°C und einen Siedepunkt von 100°C; diese Werte sind charakteristisch für das Molekül H₂O.
Die chemische Reinheit eines Reinstoffs bedeutet auch, dass er keine anderen Elemente oder Verbindungen enthält. Dies führt dazu, dass die Leistungen dieser Stoffe, z.B. ihre Fähigkeit als Lösungsmittel zu dienen, konsistent und vorhersehbar sind. Die chemische Stabilität solcher reiner Substanzen ist hoch, was sie ideal macht für zahlreiche industrielle und wissenschaftliche Anwendungen.
Zudem bleibt die Molekülstruktur eines Reinstoffs konstant, egal welche äußeren Bedingungen – innerhalb bestimmter Grenzen – angewendet werden. Diese inhärente Konsistenz ermöglicht es, präzise Berechnungen und Vorhersagen zu treffen, ein Vorteil, den Mischstoffe nicht bieten können.
Eigenschaften Stoffgemische: Variabel, Mischungsverhältnis beeinflusst Eigenschaften
- Bestehen aus zwei oder mehr verschiedenen Arten von Substanzen
- Können durch physikalische Methoden wie Filtration oder Destillation getrennt werden
- Haben keine konstanten physikalischen und chemischen Eigenschaften, da sie die Eigenschaften der enthaltenen Komponenten kombinieren
- Besitzen variable Schmelz- und Siedepunkte, abhängig von den enthaltenen Substanzen
- Die Bestandteile können in unterschiedlichen Anteilen vorliegen
Ein charakteristisches Merkmal von Stoffgemischen ist ihre variierbare Natur. Im Gegensatz zu Reinstoffen, die eine feste chemische Zusammensetzung haben, können Stoffgemische unterschiedliche Mischungsverhältnisse aufweisen. Diese Mischungsverhältnisse beeinflussen direkt die physikalischen und chemischen Eigenschaften des Gemischs.
Beispielsweise besteht Luft aus verschiedenen Gasen wie Sauerstoff, Stickstoff und Kohlendioxid. Das genaue Verhältnis dieser Gase kann jedoch je nach Ort und Umweltbedingungen variieren, was leichte Unterschiede in den physikalischen Eigenschaften der Luft zur Folge hat.
Ein weiteres Beispiel sind Legierungen, bei denen verschiedene Metalle kombiniert werden, um spezifische Eigenschaften zu erzielen. Durch die Anpassung der Mischungskomponenten können Wissenschaftler und Ingenieure die Härte, Korrosionsbeständigkeit oder Leitfähigkeit der resultierenden Legierung verändern.
Stoffgemische können sowohl homogen als auch heterogen sein. Homogene Gemische sind einheitlich verteilt, sodass die Zusammensetzung an jeder Stelle gleich ist, beispielsweise Salzwasser. Heterogene Gemische hingegen bestehen aus mehreren Phasen, wie Sand in Wasser, wo man die unterschiedlichen Komponenten deutlich sehen kann.
Die variable Natur von Stoffgemischen wirkt sich auch auf deren Anwendungsmöglichkeiten aus. Sie erlauben es, maßgeschneiderte Lösungen durch Auswahl und Kombination verschiedener Bestandteile zu schaffen, was in vielen Bereichen der Industrie und Wissenschaft genutzt wird.