Gasfreisetzung bei einer chemischen Reaktion als ein Hauptmerkmal
Die Gasentwicklung bei chemischen Reaktionen ist ein faszinierendes und weit verbreitetes Phänomen. Bei vielen chemischen Reaktionen entstehen Gase, die durch spontane oder kontrollierte Energieaufnahme oder Energieabgabe freigesetzt werden können. Diese Freisetzung kann eine Reihe von Mechanismen beinhalten, von der Zersetzung eines Stoffes bis hin zu komplexen Wechselwirkungen zwischen mehreren Reaktanden.
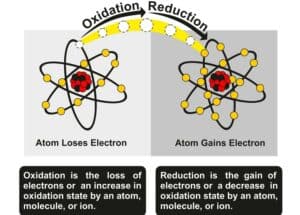
Ein zentrales Konzept hierbei ist die exotherme Reaktion, bei der Wärme frei wird und oft signifikante Mengen an Gas entstehen. Auf der anderen Seite gibt es die endotherme Reaktion, bei der Energie in Form von Wärme aufgenommen wird. Beide Reaktionstypen haben immense Bedeutung für das Verständnis und die praktische Anwendung chemischer Prozesse.
Für die effektive Handhabung und Untersuchung dieser Reaktionen sind Kenntnisse über die Reaktionsenergie, Aktivierungsenergie sowie die Bindungsenergie entscheidend. Die Freisetzung bzw. Aufnahme von Energie führt zur Wärmefreisetzung oder -absorption, was wiederum wesentliche Auswirkungen auf die Energieänderung des Systems hat. Obendrein ergeben sich daraus wichtige Sicherheitsaspekte, die bei der Durchführung solcher Experimente zu beachten sind.
Das Wichtigste in Kürze
- Exotherme und endotherme Reaktionen beeinflussen die Gasfreisetzung durch Energieabgabe oder -aufnahme.
- Wichtige Beispiele beinhalten Verbrennung, Säure-Karbonat-Reaktionen und Elektrolyse.
- Katalysatoren verringern die Aktivierungsenergie und erhöhen die Reaktionsgeschwindigkeit.
- Sicherheitsmaßnahmen sind bei gasbildenden Reaktionen essenziell, um Unfälle zu vermeiden.
- Präzise Analyseinstrumente wie Gaschromatographie und Massenspektrometrie untersuchen entstehende Gase.
Bei chemischen Reaktionen kann Gasentwicklung auftreten, wenn Gase als Reaktionsprodukte entstehen. Dies kann durch die Freisetzung von Gasen wie Kohlendioxid, Wasserstoff oder Sauerstoff erfolgen. Die Gasentwicklung ist ein wichtiges Merkmal chemischer Reaktionen und kann zu Veränderungen im Volumen oder Druck führen.
Reaktionsarten und Gasfreisetzung: Beispiele und Mechanismen
Chemische Reaktionen, bei denen Gase freigesetzt werden, spielen eine entscheidende Rolle in vielen natürlichen und industriellen Prozessen. Es gibt verschiedene Arten von Reaktionen, die zur Gasentwicklung führen können.
Verbrennungsreaktionen sind ein klassisches Beispiel für eine exotherme Reaktion, bei der Gase wie CO₂ und H₂O entstehen. Diese Reaktionen zeichnen sich durch die Wärmefreisetzung aus und setzen Energie in Form von Wärme frei.
Ein weiteres Beispiel sind säure-basierte Reaktionen. Wenn eine Säure mit einem Karbonat reagiert, wird CO₂-Gas freigesetzt. Ein bekanntes Phänomen ist hier das Aufsprudeln von Brausepulvertabletten in Wasser.
Bei Zersetzungsreaktionen zerfallen Verbindungen unter Aufnahme von Energie, was typisch für endotherme Reaktionen ist. Zum Beispiel zersetzt sich Kaliumperchlorat beim Erhitzen und setzt dabei O₂ frei.
Nicht zu vernachlässigen sind Redoxreaktionen, wie sie bei der elektrolytischen Zersetzung von Wasser auftreten. Hier wird H₂ und O₂ gasförmig erzeugt, wenn Wasser unter Stromfluss zerlegt wird.
Jede dieser Reaktionen hat ihre eigene Reaktionsenergie, die beschreibt, ob Energie aufgenommen (endotherm) oder abgegeben (exotherm) wird. Die dafür nötige Aktivierungsenergie muss überwunden werden. Die Bindungsenergie zwischen den Molekülen spielt ebenfalls eine wichtige Rolle und beeinflusst die Energieänderung während der Reaktion.
Durch Verständnis dieser Mechanismen lässt sich gezielt steuern, welche Gase entstehen und wie diese effizient genutzt oder sicher gehandhabt werden können.
Kraft und Wirkung der Chemie zeigen sich oft in den kleinsten Teilchen der Materie, und es ist unsere Aufgabe, diese Kräfte zu verstehen und zu kontrollieren. – Justus von Liebig
| Beispielreaktion | Freigesetztes Gas |
|---|---|
| Verbrennungsreaktionen | CO₂, H₂O |
| Säure-Karbonat-Reaktion | CO₂ |
| Zersetzung von Kaliumperchlorat | O₂ |
| Elektrolyse von Wasser | H₂, O₂ |
Kinetik und Thermodynamik von gasbildenden Reaktionen
Die Kinetik und Thermodynamik von gasbildenden Reaktionen sind zwei grundlegende Aspekte, die das Verhalten und die Geschwindigkeit solcher Prozesse bestimmen. Exotherme Reaktionen, bei denen Energie in Form von Wärme freigesetzt wird, verlaufen oft schneller als endotherme Reaktionen. Bei letzteren muss Energie zugeführt werden, um sie zu ermöglichen.
Ein wichtiger Faktor ist die Aktivierungsenergie, die Energiebarriere, die überwunden werden muss, damit die Reaktion stattfinden kann. Je niedriger diese Energiebarriere, desto schneller verläuft die Reaktion. Bindungsenergie spielt ebenfalls eine zentrale Rolle: Sie beschreibt die Energiemenge, die benötigt wird, um chemische Bindungen zu brechen oder zu bilden.
In thermischen Reaktionen ändert sich dabei die gesamte Reaktionsenergie. Die Richtung dieser Energieänderung bestimmt, ob eine exotherme oder endotherme Reaktion vorliegt. Exotherme Reaktionen führen zur Wärmefreisetzung, während endotherme Reaktionen eine Energieaufnahme erfordern.
Thermodynamisch betrachtet stellt die Enthalpieänderung dar, wie sich die Energie des Systems ändert. Dies beeinflusst maßgeblich die Spontaneität der Reaktion. Ein negativer Wert weist auf eine exotherme Reaktion hin, bei der Wärme an die Umgebung abgegeben wird. Andererseits bedeutet ein positiver Wert eine notwendige zusätzliche Energiezufuhr, typischer für endotherme Reaktionen.
| Reaktionstyp | Beispiel | Resultierendes Gas |
|---|---|---|
| Verbrennung | Verbrennung von Methan | CO₂, H₂O |
| Neutralisation | Essigsäure + Natriumkarbonat | CO₂ |
| Zersetzung | Erhitzen von Kaliumchlorat | O₂ |
| Elektrolyse | Aufspaltung von Wasser | H₂, O₂ |
Sicherheitsaspekte bei der Handhabung von entstehenden Gasen
Die Handhabung von gasbildenden chemischen Reaktionen erfordert besondere Vorsicht, um Unfälle und Verletzungen zu verhindern. Dabei spielen sowohl die physikalischen als auch die chemischen Eigenschaften der entstehenden Gase eine wichtige Rolle.
Explosive Gasgemische sind eine wesentliche Gefahrenquelle. Viele Gase, wie Wasserstoff oder Methan, können in bestimmten Konzentrationen mit Luft explosive Gemische bilden. Es ist daher unerlässlich, diese Gase in gut belüfteten Bereichen zu handhaben und Zündquellen zu vermeiden.
Ein weiterer Aspekt ist die Toxizität der freigesetzten Gase. Einige Reaktionsprodukte können gesundheitsschädlich sein, wenn sie eingeatmet werden. Schutzmaßnahmen wie Abzugssysteme und persönliche Schutzausrüstung sind daher obligatorisch.
Auch die richtige Lagerung der Chemikalien, die zur Gasentwicklung verwendet werden, spielt eine Rolle. Behälter sollten fest verschlossen und regelmäßig auf Undichtigkeiten überprüft werden.
Zusätzlich muss die Aktivierungsenergie der Reaktion beachtet werden, da sie Einfluss auf die Energieabgabe oder Energieaufnahme während der Reaktion hat. Bei exothermen Reaktionen kann unkontrolliert freigesetzte Wärme zu Überhitzungen und Bränden führen.
Schließlich sollte immer ein Notfallplan bereitstehen, um im Falle eines Unfalls schnell und effektiv reagieren zu können. Dazu gehören unter anderem Feuerlöscher, Augenduschen und Erste-Hilfe-Ausrüstungen.
Apparaturen zur Erfassung und Analyse von Gasen
Zur Erfassung und Analyse von Gasen bei chemischen Reaktionen werden eine Vielzahl von Apparaturen eingesetzt. Diese Instrumente erlauben genaue Messungen der freigesetzten Gase und helfen, die zugrunde liegenden Mechanismen besser zu verstehen.
Eine häufig genutzte Methode ist die Gaschromatographie (GC). Mit GC können Gase basierend auf ihren physikalisch-chemischen Eigenschaften getrennt und quantitativ bestimmt werden. Ein weiteres wichtiges Gerät ist das Massenspektrometer. Es ermöglicht die Bestimmung der molekularen Zusammensetzung von Gasproben durch Ionisierung und anschließende Zerlegung der Ionen nach ihrem Masse-zu-Ladung-Verhältnis.
Neben diesen Methoden existieren verschiedene Gassammelvorrichtungen wie die Gasbürette, welche das Volumen der entstehenden Gase misst. Für die Analyse spezifischer Gase können auch Infrarotsensoren verwendet werden, da viele Gase charakteristische Absorptionsbänder im Infrarotbereich besitzen.
Die präzise Erfassung und Analyse von Gasentwicklungen spielt eine entscheidende Rolle in vielen Bereichen der Forschung und Industrie. Dazu gehört beispielsweise die Untersuchung der Bindungsenergie und der Aktivierungsenergie bei bestimmten chemischen Reaktionen. Auch Sicherheitsaspekte erfordern oft genaue Kenntnisse über die Menge und Art der freigesetzten Gase, um entsprechende Maßnahmen einleiten zu können.
Durch diese Technologien wird es möglich, sowohl die Energieaufnahme als auch die Energieabgabe von gasbildenden Reaktionen zu verstehen und zu quantifizieren. Das Wissen darüber ist essenziell für die Kontrolle und Optimierung chemischer Prozesse, vor allem wenn es um exotherme oder endotherme Reaktionen geht.
Anwendungen von Gasentwicklungen in Industrie und Forschung
In der Industrie und Forschung spielt die Gasentwicklung eine wichtige Rolle bei zahlreichen Anwendungen. So wird beispielsweise in der chemischen Industrie häufig Wasserstoffgas durch Dampfreformierung oder Elektrolyse erzeugt, um es als Energieträger oder zur Ammoniakherstellung zu verwenden.
Bei exothermen Reaktionen wie der Verbrennung von Kohlenwasserstoffen dient die freigesetzte Energie zur Strom- und Wärmeerzeugung. Diese Prozesse sind oftmals mit einer erheblichen Wärmefreisetzung verbunden, was wiederum ihre Effizienz steigern kann.
In Laboren werden Gase ebenfalls vielseitig genutzt. Sauerstoff wird etwa als Oxidationsmittel in analytischen Methoden eingesetzt. Auch in der pharmazeutischen Forschung kommen gasbildende Reaktionen zum Einsatz, insbesondere bei der Synthese neuer Wirkstoffe, wo die Aktivierungsenergie eine entscheidende Rolle spielt.
Ein weiteres Anwendungsgebiet ist die Materialwissenschaft, wo Gasschmelzen helfen, Metalle und Legierungen herzustellen. Hierbei zeigen sich deutliche Unterschiede in der Reaktionsenergie je nach den spezifischen thermischen Reaktionen, die durchgeführt werden. Die präzise Kontrolle der dabei entstehenden Bindungsenergie und der resultierenden Energieänderung kann maßgeblich die Qualität des Endprodukts beeinflussen.
Diese Beispiele verdeutlichen, wie vielfältig die Verwendung von Gasentwicklungen sowohl in der Industrie als auch in der Forschungslandschaft ist, wobei die entsprechenden Sicherheitsmaßnahmen stets berücksichtigt werden müssen.
Einfluss von Katalysatoren auf Gasentstehung
Katalysatoren spielen eine entscheidende Rolle bei der Gasentstehung in chemischen Reaktionen. Sie beschleunigen die Reaktion, indem sie die Aktivierungsenergie herabsetzen, was es den Reaktanten ermöglicht, schneller und effizienter zu reagieren. Dies führt oft zu einer erhöhten Gasfreisetzung oder verändert zumindest das Profil der Gasentwicklung.
Die Anwesenheit eines Katalysators kann beispielsweise eine exotherme Reaktion begünstigen, bei der Energie in Form von Wärme freigesetzt wird. In solchen Fällen beeinflusst der Katalysator nicht nur die Geschwindigkeit der Reaktion, sondern auch die Gesamtmenge des entstehenden Gases. Zudem kann ein Katalysator stabilere reaction pathways öffnen, welche geringeren Energieaufwand erfordern und somit die Reaktionsenergie verringern.
Bei endothermen Prozessen, bei denen Energie aufgenommen wird, kann ein Katalysator trotzdem nützlich sein, um die notwendigen Bedingungen für die Gasbildung zu erreichen. Hier reduzieren Katalysatoren die benötigte Energieaufnahme, wodurch die Bildung von Gasen erleichtert wird.
Ein klassisches Beispiel wäre die Nutzung von Platinkatalysatoren bei der Ammoniaksynthese nach dem Haber-Bosch-Verfahren. Ein solcher Katalysator sorgt dafür, dass Stickstoff und Wasserstoff unter moderaten Bedingungen zu Ammoniak reagieren, wobei auch Gase freiwerden.
Zusammengefasst führen Katalysatoren durch die Senkung der Aktivierungsenergie nicht nur zu einer schnelleren Reaktion, sondern auch zu einer kontrollierten und je nach Bedarf verstärkten Gasentstehung.